Окклюзионная болезнь периферических артерий: что мы можем сделать для пациента уже сегодня?
Окклюзионная болезнь периферических артерий: что мы можем сделать для пациента уже сегодня?
Окклюзионная болезнь периферических артерий нижних конечностей (ОБПА; облитерирующий атеросклероз артерий нижних конечностей) является важным и очень распространенным проявлением системного атеросклероза, которое приводит к существенному ограничению способности больных к передвижению, снижению качества их жизни и ассоциируется с высоким риском сердечно-сосудистой заболеваемости и смертности [1]. Следует отметить, что согласно современному определению, приведенному в практическом руководстве Американской коллегии кардиологов и Американской ассоциации сердца (2005), под термином ОБПА понимают атеросклеротическое поражение не только артерий нижних конечностей, но и других периферических сосудов — в частности, артерий, кровоснабжающих внутренние органы (за исключением коронарных артерий) и головной мозг [2]. Распространенность ОБПА увеличивается с возрастом, и у лиц старших возрастных групп без сопутствующей эндокринной патологии, по данным отдельных эпидемиологических исследований, колеблется в достаточно широких пределах (от 2,5% в группе лиц моложе 65 лет до 18,8% в группе лиц старше 70 лет), составляя в среднем около 12 % [1, 3, 4, 8]. Прогноз у пациентов с ОБПА нижних конечностей в целом неблагоприятен: среди пациентов с перемежающейся хромотой (ПХ) уровень смертности составляет 3-5% в год, среди больных с критической ишемией нижних конечностей – более 20% в год [13].
Как поставить диагноз ОБПА, или как часто Вы измеряете пациентам АД на ногах?
К сожалению, в условиях реальной клинической практики все еще имеет место гиподиагностика ОБПА. Казалось бы, настороженность практикующих врачей в отношении кардиоваскулярной и цереброваскулярной патологии, в основе которой лежит атеросклероз (ИБС, инфаркт миокарда, ишемический инсульт), и так достаточно высока. Усилия специалистов здравоохранения, направленные на ее профилактику, своевременную диагностику, адекватное лечение и реабилитацию пациентов, уже увенчались значительными успехами, особенно в развитых странах. Удивительно, но ОБПА, в основе развития которой лежит тот же системный атеросклеротический процесс, пока, к сожалению, не стала предметом же столь пристального внимания практикующих врачей первичного звена здравоохранения. Вместе с тем, ее медико-социальная значимость отнюдь не меньше – это коварное заболевание, многие годы протекающее субклинически, как само по себе существенно снижает качество жизни больных и характеризуется высокими показателями инвалидизации и смертности, так и является очень точным «маркером» высокого риска основных кардио- и цереброваскулярных событий (фатального и нефатального инфаркта миокарда, фатального и нефатального ишемического инсульта). Характерно, что относительный риск сердечно-сосудистой смерти при ОБПА не зависит от наличия у пациентов проявлений коронарной или цереброваскулярной недостаточности [9,10]; тяжесть ОБПА тесно коррелирует с риском острого инфаркта миокарда, ишемического инсульта и сосудистой смерти [2,11].
Между тем, постановка клинического диагноза ОБПА не представляет большой сложности и фактически доступна любому врачу! Важнейшим критерием постановки диагноза ОБПА и показателем выраженности этого заболевания является так называемыйлодыжечно-плечевой индекс (ЛПИ, ankle-brachial index — ABI) — соотношение систолического артериального давления (САД), определенного на лодыжке (на a. dorsalis pedis и задней большеберцовой артерии), и САД на руке (на плечевой артерии). Для определения ЛПИ врач может использовать как обычный аппарат для измерения артериального давления, так и УЗИ-аппарат. Важно помнить, что измерение САД на обеих ногах и оценку ЛПИ следует проводить после 10-минутного отдыха пациента в положении лежа. В норме ЛПИ составляет 0,91-1,30; клинический диагноз ОБПА нижних конечностей может быть установлен при снижении этого показателя <0,9. При снижении ЛПИ <0,4 у пациента констатируют наличие тяжелой ОБПА нижних конечностей. В ряде случаев ЛПИ при ОБПА находится в пределах нормы, но после физической нагрузки снижается на 20 % и более. Чем ниже ЛПИ, тем выше риск угрожающих жизни сердечно-сосудистых и цереброваскулярных исходов. Смертность среди пациентов с тяжелой ишемией нижних конечностей, по данным некоторых авторов, достигает 25 % в год [5]. О важности рутинной оценки ЛПИ и выявления асимптомного течения ОБПА у всех пациентов с высоким кардио- и цереброваскулярным риском свидетельствуют и результаты последних клинических исследований, выполненных в соответствии с принципами доказательной медицины. Так, в ходе клинического исследования с участием 747 пациентов с диагнозом ишемического инсульта или транзиторной ишемической атаки (ТИА), результаты которого стали доступны он-лайн в январе этого года [12], было показано, что снижение ЛПИ ниже 0,9 отмечается у 18,1% таких больных и достоверно коррелирует с возрастом старше 60 лет (р<0,0001), а также с анамнезом предшествующих ишемических событий, включая ИБС (р=0,001), атеросклеротическое поражение сосудов головного мозга (р=0,002) и фибрилляцию предсердий (р=0,036). Авторы этого исследования заключают, что ЛПИ целесообразно определять у всех пациентов с ишемическим инсультом, так как это поможет не только своевременно диагностировать ОБПА, но и выделить группу больных, подверженных особенно высокому риску повторного острого нарушения мозгового кровообращения и других сосудистых осложнений.
Наиболее важным клиническим проявлением ОБПА нижних конечностей является перемежающаяся хромота (ПХ), встречающаяся приблизительно у каждого третьего пациента с этой формой атеросклероза. ПХ характеризуется болями в одной или обеих ногах при ходьбе, которые могут значительно ограничивать способность пациента к передвижению, но обычно значительно ослабевают в покое. Кроме того, при ОБПА нередко наблюдаются судороги и выраженная слабость в ногах, также провоцируемые ходьбой. Как правило, ПХ развивается достаточно медленно. Ее тяжелая форма с выраженной ишемией нижних конечностей (резкие боли в покое, трофические язвы, гангрена) встречается всего в 5-10 % случаев, но ассоциируется с очень высоким риском потери ноги. Однако более чем у половины больных с ОБПА типичная ПХ не обнаруживается. Заболевание проявляется у них только уменьшением ЛПИ (0,41-0,90), быстрой утомляемостью при ходьбе, тяжестью в нижних конечностях и снижением качества жизни. Таким образом, в большинстве случаев ОБПА проявляется в основном функциональными нарушениями, ведущими к ограничению подвижности пациентов [1]. Показано, что симптоматические формы ОБПА представляют собой лишь «вершину айсберга»: количество пациентов с бессимптомным течением заболевания, диагностированного с помощью неинвазивных методов, в 3-4 раза превышает число тех, у кого отмечается ПХ [13].
В фокусе особого внимания – пациенты высокого риска
Согласно современным представлениям, к главным факторам риска развития ОБПА относят возраст старше 40 лет, мужской пол, табакокурение и сахарный диабет (СД). По данным масштабного многоцентрового исследования PARTNERS [6], участие в котором в целом приняли 6 979 пациентов, среди лиц старше 70 лет, а также в группе лиц в возрасте 50-69 лет, которые курят или страдают СД, распространенность ОБПА (оценивалась амбулаторно посредством определения ЛПИ) достигает 29% — то есть, данная патология имеет место практически у каждого третьего. Наличие СД достоверно повышает частоту ОБПА – если среди с лиц с нормальной толерантностью к глюкозе распространенность ОБПА составляет 12,5% случаев, то при нарушении толерантности к глюкозе и СД она достигает 19,9 и 22, 4% соответственно [7]. Другими важными факторами риска развития ОБПА являются гиперлипидемия, артериальная гипертензия, гипергомоцистеинемия и повышение уровня СРБ в плазме крови [2]. Характерный профиль этих факторов, системность атеросклеротических поражений в сочетании с высоким риском ишемических сосудистых катастроф служат основанием для проведения при ОБПА мероприятий по вторичной профилактике атеротромботических осложнений, включая агрессивную гиполипидемическую терапию, лечение СД и артериальной гипертензии, назначение антитромбоцитарных средств. К сожалению, до сих пор вторичная профилактика при ОБПА, в частности, гиполипидемическая и антитромбоцитарная терапия, проводится значительно реже, чем, например, при ишемической болезни сердца, хотя ее необходимость при данном заболевании ничуть не меньше [1].
Согласно рекомендациям АСС/АНА (2005) детальное клиническое обследование нижних конечностей с определением пульсации периферических артерий и оценкой ЛПИ в обязательном порядке должно проводиться всем лицам, имеющим высокий риск развития ОБПА. К ним относятся [2]:
- пациенты в возрасте моложе 50 лет, страдающие СД или имеющие другие факторы риска развития атеросклероза (курение, дислипидемия, артериальная гипертензия и гипергомоцистеинемия);
- лица в возрасте 50-69 лет, имеющие анамнестичексие сведения о табакокурении и наличии СД;
- лица в возрасте 70 лет и старше;
- пациенты с наличием характерной клинической симптоматики со стороны нижних конечностей, возникающей при физической нагрузке (ПХ) или болевого синдрома ишемического характера, возникающего в покое;
- пациенты с отклонениями от нормы показателей пульсации артерий нижних конечностей, выявленными при физикальном обследовании;
- пациенты, которым уже установлен диагноз атеросклеротического поражения коронарных, сонных или почечных артерий.
Пациентам, у которых имеет место характерная для ОБПА нижних конечностей клиническая картина или выявлено снижение ЛПИ <0,9, показано проведение дополнительного инструментального обследования – в первую очередь, ультразвуковой допплерографии и стандартного тредмил-теста. В качестве неинвазивных методов исследования также может быть использовано ультразвуковое ангиосканирование, благодаря которому можно с большой долей достоверности определить степень стенотического поражения. В последнее время в диагностике ОБПА все шире применяется дуплексное ультразвуковое ангиосканирование, характеризующееся неинвазивностью, безопасностью для пациента, а также высокой чувствительностью и специфичностью. По данным дуплексного ангиосканирования определяется не только структура атеросклеротической бляшки, но и оценивается гемодинамическая степень стеноза, что имеет принципиальное значение. Рентгеноконтрастное ангиографическое исследование в настоящее время остается основным методом диагностики облитерирующих заболеваний сосудистого русла. С помощью этого метода возможно точно определить локализацию, протяженность, степень и характер стеноза, множественность окклюзионных поражений магистральных артерий нижних конечностей, оценить состояние коллатерального русла, прогнозировать характер и объем реконструктивной операции, а также осуществлять контроль за эффективностью лечения и хирургического вмешательства. В арсенале ангиологов и сосудистых хирургов имеются также такие методы диагностики, как лазерная допплер-флоуметрия, транскутанное мониторирование О2, фотоплетизмография, радиоизотопное исследование, компьютерная томография и ядерно-магнитный резонанс [14].
Прогрессирование и исходы заболевания, или что же ждет пациента с ОБПА без лечения?
Как уже было отмечено, для пациентов с ОБПА характерен очень высокий риск кардиоваскулярных ишемических событий, поскольку атеросклероз является системным, мультифокальным патологическим процессом, и у подавляющего большинства таких больных наряду с поражением периферических артерий имеет место и атеросклеротическое поражение коронарных и церебральных артерий. При этом у пациентов с ОБПА нижних конечностей кардиоваскулярные события развиваются достоверно чаще, чем ишемические осложнения со стороны собственно артерий нижних конечностей [15] (рисунок). При клиническом обследовании в сочетании с регистрацией ЭКГ ИБС диагностируют у 40-60% пациентов с ОБПА, а при коронарографии – у 90% больных [13].
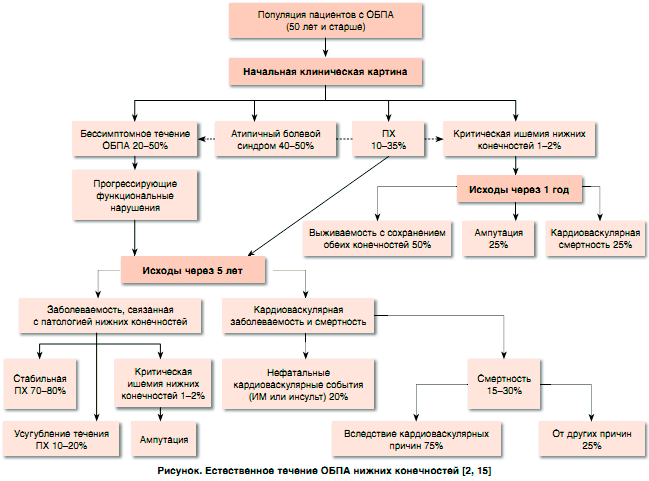
Пациенты с атеросклеротическим поражением артерий нижних конечностей могут:
а) оставаться асимптомными (без клинических симптомов ишемии нижних конечностей, но с наличием функциональных нарушений);
б) иметь клинические признаки ишемии нижних конечностей (классическая картина ПХ или атипичная симптоматика);
в) иметь критическую ишемию нижних конечностей. Для всех пациентов с ОБПА нижних конечностей характерен высокий риск прогрессирования ишемии нижних конечностей, равно как и высокий риск кардиоваскулярных ишемических событий и смерти. Частота кардиоваскулярных событий и летальность особенно высоки в группе больных с ПХ или критической ишемией нижних конечностей.
Что же касается цереброваскулярных заболеваний, то они также очень часто встречаются у пациентов с ОБПА в качестве сочетанной патологии. Так, у 12-25% пациентов с ОБПА нижних конечностей при проведении дуплексной ультрасонографии выявляют гемодинамически значимые стенозы сонных артерий [16-18]. При этом, как было показано в одном из исследований, у около 30% пациентов с выраженным стенозом сонных артерий отмечаются симптомы ишемии мозга [17]. Установлено, что тяжесть ОБПА кореллирует с выраженностью и протяженностью стеноза сонных артерий [19]. Таким образом, все врачи, занимающиеся ведением пациентов с ОБПА нижних конечностей, должны проявлять особую настороженность в отношении частого наличия у таких больных в качестве сопутствующей патологии ИБС и цереброваскулярных заболеваний. Вследствие сосуществования указанных патологий у пациентов с ОБПА нижних конечностей отмечается и значительно повышенный риск кардио- и цереброваскулярных осложнений: ИМ, инсульта и смерти вследствие сердечно-сосудистых причин. Риск ИМ у пациентов с ОБПА нижних конечностей повышается на 20-60%, а риск смерти от любых осложнений ИБС – в 2-6 раз. Риск инсульта при наличии ОБПА нижних конечностей повышается примерно на 40%; при этом степень тяжести ОБПА коррелирует с частотой ТИА и инсультов [2].
Современные подходы к консервативной терапии пациентов с ОБПА
Согласно руководству АСС/АНА (2005) по ведению пациентов с ОБПА, одной из главных целей лечения пациентов с ОБПА нижних конечностей должно быть снижение риска кардиоваскулярных событий. У пациентов с ОБПА консервативное лечение должно проводиться пожизненно и включать воздействие на все модифицируемые факторы риска прогрессирования атеросклероза: отказ от табакокурения, соблюдение гиполипидемической диеты и медикаментозная коррекция дислипидемии, контроль гликемии при нарушении толерантности к глюкозе и СД, достижение целевых уровней АД, регулярное выполнение физических упражнений. Вторичная профилактика ишемических осложнений у пациентов с ОБПА подразумевает агрессивную гиполипидемическую терапию статинами (уровень доказательности В) и назначение антитромбоцитарных препаратов (уровень доказательности А), однако значение такого рода превентивных мероприятий в отношении ОБПА, к сожалению, в реальной клинической практике зачастую недооценивается, хотя при этом заболевании они показаны не в меньшей степени, чем при ИБС [1,2]. С целью снижения риска ИМ, инсульта, застойной сердечной недостаточности и кардиоваскулярной смертности всем пациентам с ОБПА нижних конечностей и АГ показана антигипертензивная терапия, которая предполагает достижение целевого уровня АД ниже 140/90 мм рт.ст. у больных без СД и ниже 130/80 мм рт. ст. – у пациентов с СД и хронической болезнью почек (уровень доказательности А).
У многих больных с ОБПА нижних конечностей наблюдается симптоматика ПХ. В настоящее время ее фармакотерапия является отдельной, объективно трудной клинической проблемой. В качестве начального подхода к лечению в руководстве АСС/АНА (2005) предлагаются немедикаментозные мероприятия – регулярные физические упражнения на тредмиле, выполняемые под контролем физиотерапевта или специально обученной медицинской сестры. Рекомендованная продолжительность одного такого занятия составляет 30-45 мин: регулярность их проведения – не менее 3-х раз в нед в течение как минимум 12 нед (уровень доказательности А). На фоне регулярной ходьбы на тредмиле под наблюдением медицинских работников у пациентов с ПХ отмечается уменьшение выраженности симптоматики, увеличение скорости ходьбы и удлинение дистанции безболевой ходьбы [2]. Что же касается медикаментозного лечения, то при ПХ может быть рекомендована терапия пентоксифиллином (уровень доказательности С) и в настоящее время он рассматривается в качестве альтернативного препарата 2-й линии. За рубежом в качестве высокоэффективного препарата 1-й линии у пациентов с ПХ применяют ингибитор фосфодиэстеразы 3 типа цилостазол, значительно улучшающий функциональное состояние больных и увеличивающий «безболевую» проходимую дистанцию (уровень доказательности А). Однако в Украине этот препарат пока не зарегистрирован. Что же касается пероральных вазодилатирующих простагландинов (берапрост, илопрост), на которые в свое время возлагались большие надежды в лечении ПХ, то в настоящее время признано, что их применение у данной категории пациентов с целью увеличения дистанции безболевой ходьбы является неэффективным (уровень доказательности А) [2]. Таким образом, с одной стороны, на сегодняшний день реальная ситуация с консервативным лечением ОБПА нижних конечностей и ПХ как ее ключевого клинического проявления, к сожалению, все еще оставляет желать лучшего. Но с другой стороны, это стимулирует ученых и клиницистов к активному изучению новых подходов к лечению этого заболевания и оценке эффективности лекарственных средств, еще не в полной мере раскрывших своей терапевтический потенциал.
Роль эндотелиальной дисфункции в развитии атеросклероза и практические возможности ее коррекции
Поскольку мультифокальный атеросклероз как системное заболевание требует системных подходов к лечению, в последние годы значительное внимание уделяется поиску новых подходов к этиопатогенетической терапии ОБПА нижних конечностей как одному из закономерных локальных проявлений данного универсального патологического процесса. Как уже упоминалось, важнейшую роль в комплексном лечении таких больных играет интенсивная гиполипидемическая терапия современными лекарственными препаратами. Вместе с тем, этиопатогенез атеросклеротического поражения сосудов очень сложен и многогранен, и помимо нарушений липидного обмена включает еще несколько важных звеньев, центральным из которых на сегодняшний день признана эндотелиальная дисфункция. В настоящее время убедительно доказано, что эндотелий является первым барьером на пути реализации влияния на организм неблагоприятных факторов внешней среды (Furchgott R.F., 1980, Davignon, 2004). Именно утрата нормальной функции эндотелия выступает первым этапом развития атеросклеротического процесса: под воздействием хорошо известных факторов риска постепенно формируется эндотелиальная дисфункция, происходит утолщение интимы сосудистой стенки, образуются атеросклеротические бляшки, что с течением времени закономерно заканчивается нарушением их целостности и развитием атеротромбоза. Таким образом, нормально функционирующий эндотелий является тем уникальным «биологическим щитом», который непосредственно отвечает за все основные физиологические процессы в сосудах: регулирование тонуса сосудистой стенки, поддержание суспензионной стабильности крови и баланса локальных воспалительных, свободнорадикальных, метаболических и пролиферативных реакций [20]. Эндотелиоциты синтезируют целый ряд биологически активных субстанций, принимающих участие в регуляции воспалительного ответа (ФНО-α, супероксидные радикалы, С-натрийуретический пептид, оксид азота и др.), гемостаза (тромбоцитарный ростовой фактор, тканевой активатор плазминогена и ингибитор активатора плазминогена, фактор Виллебранда, ангиотензин-IV, эндотелин-I, простациклин, оксид азота), процессов роста и пролиферации (ангиотензин, эндотелин-I, супероксидные радикалы, простациклин, С-натрийуретичеcкий пептид, оксид азота) и наконец, в регуляции тонуса гладкой мускулатуры сосудов (эндотелин, ангиотензин II, тромбоксан А2, простациклин, эндотелиальный фактор деполяризации, оксид азота). Лишь взглянув на неполный перечень этих веществ, нетрудно заметить, что центральная роль во всех этих процессах принадлежит оксиду азота (NO) – именно эта молекула оказывает мощное защитное воздействие на все перечисленные функции эндотелия и именно она является главной «мишенью» для фармакологической коррекции эндотелиальной дисфункции. Вопрос о том, как увеличить синтез NO эндотелиоцитами и повысить его биодоступность, сегодня не зря относится к числу одних из самых важных в кардиологии, неврологии и ангиологии: ведь таким способом можно будет разорвать порочный круг прогрессирования атеросклероза и восстановить сосудистый гомеостаз, нарушенный у всех без исключения пациентов с заболеваниями, в основе которых лежит эндотелиальная дисфункция. Одним из подходов к решению этой задачи является применение так называемых донаторов оксида азота, к которым в первую очередь следует отнести L-аргинин (Тивортин) – незаменимый и единственный субстрат для синтеза NO в физиологических условиях. К основным фармакологическим эффектам препарата Тивортин, обусловливающим его вазодилататорную и ангиопротекторную активность, можно отнести:
- способность восстанавливать эндотелийзависимую вазодилатацию при атеросклерозе;
- стимуляцию синтеза оксида азота – L-аргинин является субстратом для NО-синтазы (фермента, который катализирует синтез оксида азота в эндотелиоцитах);
- уменьшение адгезии лейкоцитов и тромбоцитов к эндотелию;
- уменьшение агрегации тромбоцитов;
- ингибирование синтеза эндотелина-I, который является мощным вазоконстриктором и стимулятором пролиферации и миграции гладкомышечных клеток сосудистой стенки;
- способность угнетать синтез протеинов адгезии VCAM-1 и MCP-1, предотвращая таким образом образование и развитие атеросклеротических бляшек;
- антиоксидантное действие.
Благодаря столь многогранному спектру фармакологической активности, включающему в первую очередь стимуляцию синтеза NO, Тивортин является высокоэффективным эндотелиопротектором, замедляющим прогрессирование атеросклероза. Атеросклероз коронарных и церебральных сосудов сердца, а также атеросклероз периферических сосудов, в том числе с проявлениями ПХ, в настоящее время относят к числу основных показаний к клиническому применению этого препарата.
Терапевтические возможности L-аргинина при ОБПА:
результаты рандомизированных клинических исследований
Итак, применение L-аргинина у пациентов с ОБПА представляется вполне обоснованным и логичным с точки зрения этиопатогенеза атеросклеротического поражения сосудов: установлено, что при ОБПА выражено нарушается опосредованная NO эндотелий-зависимая вазодилатация [21], а L-аргинин улучшает этот процесс у пациентов с атеросклерозом и гиперхолестеринемией [22]. А что же говорят об эффективности L-аргинина у пациентов с ОБПА и ПХ данные доказательной медицины?
В ходе проведенного немецкими учеными двойного слепого плацебо-контролируемого клинического исследования [23] было доказано, что восстановление синтеза NO сосудистым эндотелием, достигаемое при пролонгированном инфузионном введении L-аргинина в дозе 8 г 2 раза в сутки, приводит к значимому улучшению клинического состояния пациентов с ПХ. Так, после 3-х нед парентеральной терапии L-аргинином у пациентов было констатировано достоверное увеличение дистанции безболевой ходьбы и максимально проходимой дистанции (р<0,05). Кроме того, на фоне терапии L-аргинином было констатировано улучшение эндотелий-зависимой вазодилатации бедренной артерии – при этом данный эффект не был выявлен на фоне лечения простагландином Е1. В данном также исследовании было продемонстрировано наличие линейной корреляции между исходным соотношением L-аргинин/ассиметрический диметиларгинин (ADMA) в плазме крови и дистанцией безболевой ходьбы на момент включения в исследование. Известно, что ADMA представляет собой мощный эндогенный стимулятор оксидативного стресса, а аргинин угнетает его синтез. Как показал анализ результатов, полученных после 3-х нед введения L-аргинина, такая терапия обеспечивает повышение плазменного коэффициента L-аргинин/ADMA и увеличение экскреции нитратов и цГМФ с мочой, что свидетельствует о нормализации синтеза эндогенного NO.
Интересные результаты об эффектах L-аргинина получены и в другом двойном слепом плацебо-контролируемом рандомизированном клиническом исследовании [25], в ходе которого пациентам с ОБПА И ПХ рекомендовали в течение 2-х нед L-аргинин 3,3 г. Период последующего наблюдения за пациентами в данном исследовании составлял 8 нед. Было показано, что после 2 нед ежедневного употребления 6,6 г L-аргинина у пациентов отмечается увеличение на 66% дистанции безболевой ходьбы, увеличение на 23% максимальной дистанции ходьбы и на 10% — качества жизни согласно опроснику Medical Outcome Survey.
Клинические исследования по применению L-аргинина у пациентов ОБПА нижних конечностей проводились и в США. В одном из пилотных клинических исследований, участие в котором приняли 80 пациентов с ПХ, была предпринята попытка установить минимально эффективную дозу L-аргинина при данной патологии. Было показано, что у больных с ПХ, в зависимости от условий рандомизации принимавших L-аргинин перорально дозе 3 г/сут, 6 г/сут и 9 г/сут в течение 12 нед, отмечается тенденция к повышению скорости ходьбы, при этом большее увеличение дистанции ходьбы отмечалось у пациентов, получавших L-аргинин в дозе 3 г/ сут. При этом исследователями была отмечена хорошая переносимость L-аргинина и отсутствие на фоне терапии этим препаратом каких-либо значимых побочных эффектов [25].
Как реализовать преимущества L-аргинина в клинической практике?
Восполнить резерв L-аргинина как незаменимого субстрата для синтеза NO в организме пациента с ОБПА и другой сочетанной патологией, в основе которой лежит атеросклероз, усилить NO-опосредованную эндотелий-зависимую вазодилатацию периферических артерий, а значит – улучшить клиническое состояние пациента и замедлить темпы прогрессирования поражения сосудов, можно с помощью курсового применения в составе комплексной терапии отечественного препарата L-аргинина Тивортин. Он выпускается в лекарственной форме для парентерального применения (раствор для инфузий) и в форме раствора для перорального применения с удобным дозированием (1мерная ложка — 1 г препарата). Это позволяет применять Тивортин в комплексном лечении пациентов с ОБПА нижних конечностей и ПХ как на этапе стационарного лечения, так и в амбулаторной практике. Раствор для инфузий Тивортин вводится внутривенно капельно со скоростью 10 капель в минуту в первые 10–15 мин, потом скорость введения можно увеличить до 30 капель в минуту (суточная доза препарата — 100 мл раствора). При пероральном применении Тивортин принимают по 5 мл (1 мерная ложка) во время еды 3–8 раз в сутки (максимальная суточная доза — 8 г).
Таким образом, коррекция эндотелиальной дисфункции в настоящее время является одним из важных элементов системной этиопатогенетической стратегии лечения ОБПА нижних конечностей, который заслуживает широкого применения в рутинной клинической практике всех врачей, занимающихся ведением данной категории пациентов, в особенности – терапевтов и сосудистых хирургов. В качестве практического инструмента реализации данной терапевтической стратегии комплексного лечения у пациентов с ОБПА нижних конечностей и другими проявлениями мультифокального атеросклероза по праву может рассматриваться незаменимый донатор оксида азота L-аргинин (Тивортин).
Литература
- В.М. Полонский. Медикаментозное лечение окклюзионной болезни периферических артерий и перемежающейся хромоты. «Фарматека», №11 (52), 2001.
- Hirsch A.T., Haskal Z.J., Hertzer N.R. et al. ACC/AHA 2005
Practice Guidelines for the Management of Patients With Peripheral Arterial Disease (Lower Extremity, Renal, Mesenteric, and Abdominal Aortic): A Collaborative Report from the American Association for Vascular Surgery/Society for Vascular Surgery,* Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease): Endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation; National Heart, Lung, and Blood Institute; Society for Vascular Nursing; TransAtlantic Inter-Society Consensus; and Vascular Disease Foundation. Circulation,2006;113; e463-e465 - Criqui MH, Fronek A, Barret-Connor E, et al. The prevalence of peripheral arterial disease in a defined population. Circulation 1985;71-510-5.
- Hiatt WR, Hoag S, Hamman RF. Effect of diagnostic criteria on the prevalence of peripheral arterial disease: the San Luis Valley Diabetes Study. Circulation 1995;91:1472-9.
- Dormandy JA, Heeck L, Vig S. The fate of patients with critical leg ischemia. Semin Vasc Surg 1999;12:142-7.
- Hirsch AT, et al. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA. 2001;286:1317-1324
- Lee AJ, et al. The role of haematological factors in diabetic peripheral arterial disease: the Edinburgh artery study. Br J Haematol. 1999;105:648-654
- Kannel WB. The demographics of claudication and the aging of the American population. Vasc Med 1996;1:60-4.
- Newman AB, Shemanski L, Manolio TA, et al. Ankle-arm index as a predictor of cardiovascular disease and mortality in the Cardiovascular Health Study. Arterioscler Thromb Vasc Biol 1999;19:538-45.
- CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). Lancet 1996;348:1329-39.
- Hiatt WR. Medical treatment of peripheral arterial disease and claudication. N Engl J Med 2001;344:1608-21.
- Ratanakorn D., Keandoungchun J., Tegeler C.H. Prevalence and Association between Risk Factors, Stroke Subtypes, and Abnormal Ankle Brachial Index in Acute Ischemic Stroke.
J Stroke Cerebrovasc Dis. 2011 Jan 12. [Epub ahead of print]. - Verhaeghe R. Epidemiology and prognosis of peripheral obliterative arteriopathy. Drugs, 1998;56 Suppl 3:1-10.
- Затевахин И.И., Цициашвили М.Ш., Степанов Н.В., Золкин В.Н. Облитерирующие заболевания аорты и артерий нижних конечностей. «Русский медицинский журнал», 2001 г, том 9, № 3-4.
- Weitz JI, Byrne J, Clagett GP, et al. Diagnosis and treatment of chronic arterial insufficiency of the lower extremities: a critical review. Circulation, 1996;94:3026-49. Erratum in: Circulation, 2000;102:1074.
- Klop RB, Eikelboom BC, Taks AC. Screening of the internal carotid arteries in patients with peripheral vascular disease by colour-flow duplex scanning. Eur J Vasc Surg 1991;5:41-5.
- Alexandrova NA, Gibson WC, Norris JW, et al. Carotid artery stenosis in peripheral vascular disease. J Vasc Surg 1996;23:645-9.
- Cheng SW, Wu LL, Ting AC, et al. Screening for asymptomatic carotid stenosis in patients with peripheral vascular disease: a prospective study and risk factor analysis. Cardiovasc Surg 1999;7:303-9.
- Long TH, Criqui MH, Vasilevskis EE, et al. The correlation between the severity of peripheral arterial disease and carotid occlusive disease. Vasc Med 1999;4:135-42.
- В.Ю. Лишневская. Эндотелиальная дисфункция: что необходимо знать практическому врачу? «Медична газета «Здоров’я України», 2011, №2, стор. 29
- Cooke JP, Creager MA. Hypercholesterolemia, atherosclerosis, and the NO synthase pathway. In: Vallance PJ, Webb DJ, eds.Vascular Endothelium in Human Physiology and Pathophysiology. Amsterdam, the Netherlands: Harwood Academic Publishers, 2000:147-70.
- Creager MA, Gallagher SJ, Girerd XJ, et al. L-arginine improves endothelium-dependent vasodilation in hypercholesterolemic humans. J Clin Invest 1992;90:1248-53.
- Boger RH, Bode-Boger SM, Thiele W, et al. Restoring vascular nitric oxide formation by L-arginine improves the symptoms of intermittent claudication in patients with peripheral arterial occlusive disease. J Am Coll Cardiol 1998;32:1336-44.
- Maxwell AJ, Anderson BE, Cooke JP. Nutritional therapy for peripheral arterial disease: a double-blind, placebo-controlled, randomized trial of HeartBar. Vasc Med 2000;5:11-9.
- Oka R.K., Szuba A., Giacomini J.C., Cooke J.P. A pilot study of L-arginine supplementation on functional capacity in peripheral arterial disease. Vasc Med 2005;10: 265.
Материалы напечатаны в журналe Практична ангіологія 2011 12-18 № 2
Кардиопротекторный эффект донатора оксида азота у пациентов с артериальной гипертензией
Резюме: Последнее десятилетие ознаменовалось интенсивным развитием фундаментальных и клинических исследований роли сосудистого эндотелия в генезе сердечно-сосудистых заболеваний (ССЗ). Сегодня внимание исследователей приковано к изучению роли дисфункции эндотелия (ДЭ) в патогенезе ССЗ, а также к поиску способов ее эффективной коррекции. В статье приводятся данные международных и украинских публикаций о возможном кардиопротекторном эффекте донатора оксида азота у […]
ЗДОРОВЬЕ НЕФРОНА — ЗАЛОГ СТАБИЛЬНОГО АРТЕРИАЛЬНОГО ДАВЛЕНИЯ
Резюме: Хроническая болезнь почек является одним из наиболее распространенных заболеваний в мире. Наряду с повреждением собственно почки заболевание связано с большими рисками со стороны сердечно-сосудистой, эндокринной и других систем организма. Обзор представляет последние взгляды на проблему и данные исследований, а также современные терапевтические решения для всестороннего лечения заболевания и проведения патогенетически обоснованной коррекции волюмодинамики. Рассмотренный […]
