Кардиопротекторный эффект донатора оксида азота у пациентов с артериальной гипертензией
Кардиопротекторный эффект донатора оксида азота у пациентов с артериальной гипертензией
 Резюме: Последнее десятилетие ознаменовалось интенсивным развитием фундаментальных и клинических исследований роли сосудистого эндотелия в генезе сердечно-сосудистых заболеваний (ССЗ).
Резюме: Последнее десятилетие ознаменовалось интенсивным развитием фундаментальных и клинических исследований роли сосудистого эндотелия в генезе сердечно-сосудистых заболеваний (ССЗ).
Сегодня внимание исследователей приковано к изучению роли дисфункции эндотелия (ДЭ) в патогенезе ССЗ, а также к поиску способов ее эффективной коррекции.
В статье приводятся данные международных и украинских публикаций о возможном кардиопротекторном эффекте донатора оксида азота у пациентов с артериальной гипертензией.
Статья. Последнее десятилетие ознаменовалось интенсивным развитием фундаментальных и клинических исследований роли сосудистого эндотелия в генезе сердечно-сосудистых заболеваний (ССЗ). Сегодня внимание исследователей приковано к изучению роли дисфункции эндотелия (ДЭ) в патогенезе ССЗ, а также к поиску способов ее эффективной коррекции.
Клиническое значение дисфункции эндотелия при артериальной гипертензии (АГ)
Впервые термин «эндотелий» был предложен швейцарским патоморфологом Вильгельмом Гисом в 1865 г.; он был введен как дополнительный к термину «эпителий». Вильгельм Гис термином «эндотелий» обозначил эпителий, развившийся из среднего зародышевого листа. Французский анатом и эмбриолог Луи-Антуан Ранвье отметил, что под термином «эндотелий» следует определять любой однослойный плоский эпителий (независимо от его происхождения).
Такая трактовка этого термина сохранялась до 30-х годов XX века: им обозначали слой клеток, покрывающий внутреннюю поверхность сердца, кровеносных, лимфатических сосудов, серозных, синовиальных и мозговых оболочек, задней камеры глаза, респираторных путей [1].
Согласно современным представлениям, эндотелий представляет собой клеточный барьер, обеспечивающий одновременно раздельную, транспортную и обменную функции между главными компартментами тела человека – кровью и межклеточной жидкостью тканей, который также является аутокринным, паракринным, эндокринным органом с многочисленными регуляторными функциями.
Эндотелий принимает участие в регуляции сосудистого тонуса, гемостаза, иммунного ответа, миграции клеток крови к сосудистой стенке, синтезе факторов воспаления и их ингибиторов, осуществлении барьерной функции. Последняя характеризуется поддержанием баланса между вазодилатацией и вазоконстрикцией, взаимодействием между факторами роста тканей и факторами, влияющими на воспалительные процессы и определяющими взаимодействие анти- и прооксидантной, а также анти- и протромботических систем.
Следовательно, функциональное состояние эндотелия является одним из ключевых факторов, влияющих на течение атеросклеротического поражения сосудистого русла.
ДЭ представляет собой прежде всего дисбаланс между продукцией вазодилататорных, ангиопротекторных, антипролиферативных факторов, с одной стороны (простациклин, тканевой активатор плазминогена, С-тип натрийуретического пептида, эндотелиального гиперполяризующего фактора), а также вазоконстрикторных, протромботических, пролиферативных факторов, с другой стороны (эндотелин, супероксид-анион, тромбоксан А, ингибитор тканевого активатора плазминогена) [2].
Сегодня ДЭ рассматривают как ключевой момент в патогенезе атеросклероза. Нарушение вазодилатационной активности периферических сосудов является одним из многочисленных проявлений ДЭ, резко снижающейся у больных АГ, вплоть до развития вазоконстрикторных реакций, что впоследствии влечет за собой неадекватный ответ сосудистого русла и способствует устойчивому повышению артериального давления (АД).
Последний фактор приводит к поражению органов-мишеней и сопровождается развитием осложнений, конечными точками которых являются гипертрофия левого желудочка, инсульт, инфаркт миокарда, хроническая почечная недостаточность и т. д. Следовательно, ДЭ и АГ тесно связаны между собой и развиваются параллельно, поэтому только лишь снижение уровня АД без коррекции ДЭ при лечении АГ не может считаться успешно решенной клинической задачей.
Роль оксида азота (NO) в патогенезе АГ
Среди биологически активных веществ, вырабатываемых эндотелием, самое важное – NO, который на сегодняшний день является наиболее исследуемой молекулой, вовлеченной в патогенез ССЗ [3]. В 1980 г. R. F.Fuchgott и J. V. Zawadski впервые продемонстрировали, что только в случае наличия эндотелиальных клеток увеличение дозы ацетилхолина повлекло за собой релаксацию сосуда, подвергшегося предшествующей констрикции под влиянием норадреналина, в то время как при отсутствии эндотелиальных клеток наблюдалась либо вазоконстрикция, либо отсутствие релаксации [4].
Это обусловило открытие эндотелийрелаксирующего фактора, который позже был идентифицирован как NO [5]. Сегодня известно, что NO служит не только в качестве мощного вазодилататора; в то же время он тормозит процессы ремоделирования сосудистой стенки, предотвращает адгезию и агрегацию тромбоцитов, адгезию моноцитов, защищая таким образом сосудистую стенку от патологической перестройки, т. е. в нормальных физиологических условиях NO является антиатерогенным фактором.
При различных ССЗ способность эндотелиальных клеток высвобождать релаксирующие факторы, в т. ч. NO, снижается, что ассоциировано с разными причинами: нарушением экспрессии и транскрипции NO-синтазы, ускоренным метаболизмом NO, снижением доступности запасов L-аргинина, предшественника NO (или комбинацией этих факторов). Одновременно увеличивается образование сосудосужающих факторов и формируется ДЭ.
При дефиците NO происходят как ослабление вазодилатации, так и запускание процессов ремоделирования сосудистой стенки, адгезии, агрегации тромбоцитов/моноцитов. Следовательно, инициируются атерогенные процессы, поэтому дефицит NO становится проатерогенным фактором.
Сосудистое старение и артериальная жесткость
В последнее время особый интерес научного мира прикован к проблеме артериальной жесткости (артериосклерозу) при ССЗ. Первыми предпосылками, которые обусловили интерес исследователей к артериальной жесткости, стали исследования, продемонстрировавшие, что наличие факторов риска ССЗ не объясняет развитие кардиоваскулярных событий у молодых лиц.
В ходе исследования 542 тыс. пациентов с первичным инфарктом миокарда без предшествующих ССЗ у 14% испытуемых не выявлено ни одного из 5 регистрируемых традиционных факторов риска, при этом смертность в группе составила 15% [6]. В 2008 г. P.M. Nilsson создал концепцию синдрома раннего сосудистого старения (Early Vascular Aging Syndrome, EVA) – преждевременного и ускоренного развития структурных и функциональных возрастных изменений в сосудах [7].
Согласно литературным данным, повышение сосудистой жесткости и ДЭ играют одну из ключевых ролей в развитии EVA-синдрома [8].
Общий пусковой фактор развития патологических процессов в сосудистой стенке – ДЭ, при которой наблюдается нарушенный баланс медиаторов вазодилатации (NO) и вазоконстрикции (эндотелин 1), вследствие чего и повышается сосудистый тонус [9].
На ранних этапах повышение сосудистого тонуса носит исключительно функциональный характер, что приводит к увеличению периферического сосудистого сопротивления в артериях мышечного типа, а это, в свою очередь, обусловливает развитие АГ [10]. Длительное существование ДЭ и повышенного тонуса артерий приводит к гипертрофии и гиперплазии гладкомышечных клеток сосудистой стенки, активации синтеза соединительнотканного матрикса, утолщению медии артерий, что является причиной нарушения эластических свойств сосудов [11].
Следовательно, фармакотерапия ДЭ может замедлить патологическое старение сосудов и задержать или предотвратить дальнейшие сердечно-сосудистые катастрофы. L-аргинин как предшественник NO играет важную роль в коррекции ДЭ и сдерживании сосудистого старения человека [12].
Кардиопротекторная роль L-аргинина
На современном этапе считается, что лечебно-профилактические мероприятия, направленные на снижение риска осложнений при ССЗ, могут быть эффективны в уменьшении выраженности ДЭ. С улучшением функционального состояния эндотелия связывают клинические эффекты многих классов лекарственных средств, а также коррекцию факторов риска ССЗ и оптимизацию образа жизни.
Учитывая, что основным патофизиологическим механизмом в случае АГ является ДЭ и снижение биодоступности NO, введение дополнительного субстрата для усиления продукции NO может предоставить дополнительные преимущества в органопротекции при АГ.
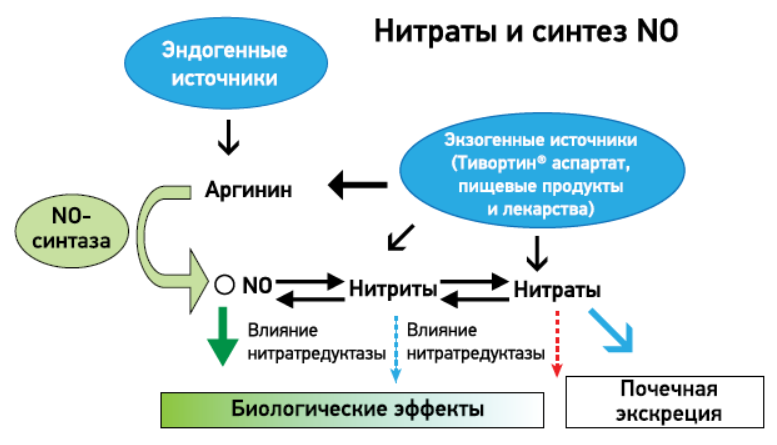
Рис. Биосинтез NO и нитратов с L-аргинина
Биосинтез NO происходит под действием фермента NO-синтазы из левовращающего изомера аргинина – L-аргинина, который, в отличие от правовращающего D-изомера, является физиологически активным (рис.) [13, 14]. Результаты многочисленных исследований продемонстрировали благоприятное влияние L-аргинина на продукцию NO, а также на функцию эндотелия как при краткосрочном, так и при длительном применении.
По результатам ряда клинических исследований, введение L-аргинина улучшало эндотелийзависимую вазодилатацию в случае гиперхолестеринемии и атеросклероза [15, 16]. В исследовании Л. А. Мищенко (2021) определено, что добавление L-аргинина пациентам с АГ на этапе выбора антигипертензивной терапии может способствовать улучшению функции эндотелия, мозгового и почечного кровотока, восстановлению цереброваскулярной реактивности, уменьшению сосудистого тонуса, а также микроальбуминурии [17].
Метаанализ 13 рандомизированных контролируемых исследований (РКИ), посвященных влиянию L-аргинина на липидный профиль и маркеры воспаления, убедительно продемонстрировал способность этой молекулы значительно снижать уровень триглицеридов и АД [18]. В исследовании W.H. Yin и соавт. (2016) у 31 пациента со стабильной ишемической болезнью сердца на фоне перорального приема L-аргинина в течение 4 нед установлено улучшение эндотелиальной функции и снижение окисления [19].
Результаты недавнего исследования определили, что внутривенное применение 4,2% раствора L-аргинина гидрохлорида в сочетании с пероральным приемом L-аргинина аспартата в комплексном лечении хронической ишемии нижних конечностей на фоне атеросклероза сосудов оказывает заметный положительный клинический эффект [20]. Проспективное двойное слепое РКИ установило значительное улучшение поток-опосредованной дилатации (с 1,7±3,4 до 5,9±5,4; р=0,008) у 18 пациентов с эссенциальной гипертензией на фоне приема 6 г/сут L-аргинина [21].
Первое исследование описания гемодинамических механизмов гипотензивного эффекта L-аргинина проведено в плацебо-контролируемом перекрестном РКИ S.G. West и соавт. (2005), результаты которого продемонстрировали, что при применении 12 г/сут L-аргинина у пациентов уменьшился сердечный выброс (на 0,4 л/мин), диастолическое АД (на 1,9 мм рт. ст.), уровень гомоцистеина в плазме (на 2,0 мкмоль/л) и увеличился период напряжения желудочков (на 34 мс) [22].
Фармацевтический рынок Украины предлагает препараты производства фармацевтической компании «Юрия-Фарм»: Тивортин® – раствор для инфузий, во флаконе по 100 и по 200 мл (100 мл содержат 4,2 г аргинина гидрохлорида) и Тивортин® аспартат – раствор для перорального использования, во флаконах по 100 и 200 мл (5 мл раствора содержат 1 г L-аргинина аспартата).
Тивортин® – левовращающий донатор NO с доказанной клинической эффективностью для защиты органов-мишеней. L-аргинин – незаменимый субстрат для синтеза NO, являющийся физиологическим ангиопротектором и физиологическим вазодилататором. Благодаря нормализации функции эндотелия L-аргинин способствует защите органов-мишеней при АГ.
Сырье для Тивортина производится на японском заводе и имеет растительное происхождение. По результатам исследования Z. Bahadoran и соавт. (2016) был сделан вывод, что L-аргинин растительного происхождения может предотвращать развитие ССЗ (в отличие от L-аргинина животного происхождения, который может являться предиктором их развития) [21].
Способ применения:
- Тивортин® вводят внутривенно капельно со скоростью 10 капель/мин в первые 10-15 мин, далее скорость введения можно увеличить до 30 капель/мин;
- суточная доза препарата – 100 мл раствора, может быть увеличена до 200 мл.
Курс терапии:
- 1-й этап: 10 дней внутривенно капельно Тивортин® 4,2% раствор для инфузии 100 мл 1-2 р/сут;
- 2-й этап: Тивортин® аспартат per os по 5 мл 2 р/сут на протяжении до 2 мес.
Таким образом, коррекция ДЭ должна быть рутинной и обязательной частью терапевтической и профилактической программы при лечении пациентов с ССЗ. Мультиплановая роль L-аргинина в метаболизме обусловливает широкий спектр его терапевтических эффектов, способствуя защите органов-мишеней при АГ. Результаты приведенных исследований определяют необходимость применения препаратов Тивортин® и Тивортин® аспартат при комплексном лечении пациентов с АГ.
Ключевые слова: артериальная гипертензия, кардиопротекция, L-аргинин.
Автор: Тащук В.К., д.м.н., профессор, заведующий кафедрой внутренней медицины, физической реабилитации и спортивной медицины Буковинского государственного медицинского университета, г. Черновцы, Украина.
ЛИТЕРАТУРА
- Марунич Р. Ю., Горницька О. В., Гудзенко А. В. та ін. (2021). Роль ендотелію в регуляції агрегатного стану крові в нормі при атеросклерозі та артеріальній гіпертензії. Фізіол. журн., Т. 67, № 3.
- Vane J. R., Anggård E. E., Botting R. M. (1990). Regulatory functions of the vascular endothelium. N Engl J Med. Jul 5; 323 (1): 27-36. doi: 10.1056/NEJM199007053230106.
- Smith O. (1998). Nobel Prize for NO research. Nat Med 4, 1215. https://doi.org/10.1038/3182.
- Furchgott R. F., Zawadzki J. V. (1980). The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature. Nov 27; 288 (5789): 373-6. doi: 10.1038/288373a0.
- Palmer R.M., Ferrige A.G., Moncada S. (1987). Nitric oxide release accounts for the biological activity of endothelium – derived relaxing factor. Nature; 327: 524-6.
- Lim P. O., Young W. F., MacDonald T.M. (2001). A review of the medical treatment of primary aldosteronism. J Hypertens. Mar; 19 (3): 353-61. doi: 10.1097/00004872-200103000-00001.
- Canto J. G., Kiefe C. I., Rogers W. J. et al. (2011). Number of coronary heart disease risk factors and mortality in patients with first myocardial infarction. JAMA. Nov 16; 306 (19): 2120-7. doi: 10.1001/jama.2011.1654.
- Nilsson P. M. Early vascular aging (EVA): consequences and prevention. Vasc Health Risk Manag.; 4: 547-52. doi: doi.org/10.2147/VHRM.S1094.
- Schmitt M., Avolio A., Qasem A. et al. (2005). Basal NO locally modulates human iliac artery function in vivo. Hypertension. Jul; 46 (1): 227-31. doi: 10.1161/01.HYP.0000164581.39811.bd.
- Schillaci G., Verdecchia P., Porcellati C. et al. (2000). Continuous relation between left ventricular mass and cardiovascular risk in essential hypertension. Hypertension. Feb; 35 (2): 580-6. doi: 10.1161/01.hyp.35.2.580.
- Tomiyama H., Ishizu T., Kohro T. et al. (2018). Longitudinal association among endothelial function, arterial stiffness and subclinical organ damage in hypertension. Int J Cardiol. Feb 15; 253: 161-166. doi: 10.1016/j.ijcard.2017.11.022.
- Perticone F., Ceravolo R., Candigliota M. et al. (2001). Obesity and body fat distribution induce endothelial dysfunction by oxidative stress: protective effect of vitamin C. Diabetes. Jan; 50 (1): 159-65. doi: 10.2337/diabetes.50.1.159.
- Соколова Л. К., Пушкарьов В. М., Тронько М. Д. (2019). L-аргінін у нормі та патології. Ендокринологія. Vol. 24. № 4. 373-385. doi: 10.31793/1680-1466.2019.24-4.373.
- Weckman A. M., McDonald C.R., Baxter J. B. et al. (2019). Perspective: L-arginine and L-citrulline Supplementation in Pregnancy: A Potential Strategy to Improve Birth Outcomes in Low-Resource Settings. Adv Nutr. Sep 1; 10 (5): 765-777. doi: 10.1093/advances/nmz015.
- Quyyumi A. A., Dakak N., Diodati J. G. et al. (1997). Effect of l-arginine on human coronary endothelium-dependent and physiologic vasodilation. J. Am. Coll. Cardiol., 1997 – Vol. 30 – p. 1220-1227.
- Lerman A., Burnett J. C.J., Higano S. T. et al. (1998). Long-term l-arginine supplementation improves small-vessel coronary endothelial function in humans. Circulation, Vol. 97, p. 2123-2128.
- Міщенко Л. А. (2020). Органопротекторні можливості L-аргініну в лікуванні пацієнтів з артеріальною гіпертензією. «Здоров’я України 21 сторіччя» № 23 (492).
- Sepandi M., Abbaszadeh S., Qobady S. et al. (2019). Effect of L-Arginine supplementation on lipid profiles and inflammatory markers: A systematic review and meta-analysis of randomized controlled trials. Pharmacol Res. Oct; 148: 104407. doi: 10.1016/j.phrs.2019.104407.
- Yin W. H., Chen J. W., Tsai C. et al. (2005). L-arginine improves endothelial function and reduces LDL oxidation in patients with stable coronary artery disease. Clin Nutr. Dec; 24 (6): 988-97. doi: 10.1016/j.clnu.2005.07.003.
- Кутовой А. Б., Люлько И. В., Амро А. и др. (2014). L-Аргинин в комплексной терапии хронической ишемии нижних конечностей при атеросклерозе. Серце і судини, № 3, С. 89-92.
- Lekakis J. P., Papathanassiou S., Papaioannou T. G. et al. (2002). Oral L-arginine improves endothelial dysfunction in patients with essential hypertension. Int J Cardiol. Dec; 86 (2-3): 317-23. doi: 10.1016/s0167-5273(02)00413-8.
- West S. G., Likos-Krick A., Brown P. et al. (2005). Oral L-arginine improves hemodynamic responses to stress and reduces plasma homocysteine in hypercholesterolemic men. J Nutr. Feb; 135 (2): 212-7. doi: 10.1093/jn/135.2.212.
- Bahadoran Z., Mirmiran P., Tahmasebinejad Z. et al. (2016). Dietary L-arginine intake and the incidence of coronary heart disease: Tehran lipid and glucose study. Nutr Metab (Lond). Mar 15; 13: 23. doi: 10.1186/s12986-016-0084-z.
Кардиопротекторный эффект донатора оксида азота у пациентов с артериальной гипертензией
Резюме: Последнее десятилетие ознаменовалось интенсивным развитием фундаментальных и клинических исследований роли сосудистого эндотелия в генезе сердечно-сосудистых заболеваний (ССЗ). Сегодня внимание исследователей приковано к изучению роли дисфункции эндотелия (ДЭ) в патогенезе ССЗ, а также к поиску способов ее эффективной коррекции. В статье приводятся данные международных и украинских публикаций о возможном кардиопротекторном эффекте донатора оксида азота у […]
ЗДОРОВЬЕ НЕФРОНА — ЗАЛОГ СТАБИЛЬНОГО АРТЕРИАЛЬНОГО ДАВЛЕНИЯ
Резюме: Хроническая болезнь почек является одним из наиболее распространенных заболеваний в мире. Наряду с повреждением собственно почки заболевание связано с большими рисками со стороны сердечно-сосудистой, эндокринной и других систем организма. Обзор представляет последние взгляды на проблему и данные исследований, а также современные терапевтические решения для всестороннего лечения заболевания и проведения патогенетически обоснованной коррекции волюмодинамики. Рассмотренный […]
