Биодоступность аргинина при ишемической болезни сердца: новые данные открывают новые перспективы лечения
Биодоступность аргинина при ишемической болезни сердца: новые данные открывают новые перспективы лечения
Как известно, патоморфологической основой развития ишемической болезни сердца (ИБС) является атеросклероз коронарных артерий, который, по сути, представляет собой системный патологический процесс и требует системных подходов к лечению. На сегодняшний день ключевая роль в комплексном консервативном лечении пациентов с ИБС отводится интенсивной гиполипидемической терапии. Однако помимо нарушений липидного обмена этиопатогенез атеросклеротического поражения сосудов (в том числе коронарных) включает еще несколько важных звеньев, центральным из которых на сегодняшний день признана эндотелиальная дисфункция (ЭД). Эндотелий представляет собой тонкую полупроницаемую мембрану, отделяющую кровоток от более глубоких структур сосуда, которая непрерывно вырабатывает огромное количество биологически активных веществ, в связи с чем является гигантским паракринным органом. Главная роль эндотелия заключается в поддержании гомеостаза путем регуляции противоположных процессов, происходящих в организме (Бувальцев В.И., 2001; Коноплева Л.Ф., 2011):
• тонуса сосудов (баланса вазоконстрикции и вазодилатации);
• анатомического строения сосудов (потенцирование и ингибирование факторов пролиферации);
• гемостаза (потенцирование и ингибирование факторов фибринолиза и агрегации тромбоцитов);
• местного воспаления (выработка про- и противовоспалительных факторов).
В настоящее время убедительно доказано, что эндотелий является первым барьером на пути реализации влияния на организм неблагоприятных факторов внешней среды (Furchgott R.F., 1980; Davignon, 2004). Именно утрата нормальной функции эндотелия выступает первым этапом развития атеросклеротического процесса: под воздействием хорошо известных факторов риска постепенно формируется ЭД, происходит утолщение интимы сосудистой стенки, образуются атеросклеротические бляшки, что с течением времени закономерно заканчивается нарушением их целостности и развитием атеротромбоза. В механизме развития ЭД основное значение придается оксидативному стрессу, продукции мощных вазоконстрикторов (эндопероксиды, эндотелины, ангиотензин II), а также цитокинов и фактора некроза опухоли (ФНО), подавляющих продукцию NO (Белоусов Ю.Б., Намсараев Ж.Н., 2004). Причинами ЭД являются все основные факторы риска сердечно- сосудистых заболеваний, такие как курение, гиперхолестеринемия, артериальная гипертензия, сахарный диабет (СД) (Brown A.A., Hu F.B., 2001). К факторам риска развития ЭД также относятся преклонный возраст, мужской пол, избыточная масса тела, повышенные уровни липопротеидов низкой плотности (ЛПНП) и триглицеридов в крови.
Эндотелиоциты синтезируют целый ряд биологически активных субстанций, принимающих участие в регуляции воспалительного ответа (ФНО-α, супероксидные радикалы, С-натрийуретический пептид, оксид азота и др.), гемостаза (тромбоцитарный ростовой фактор, тканевой активатор плазминогена и ингибитор активатора плазминогена, фактор Виллебранда, ангиотензин IV, эндотелин I, простациклин, оксид азота), процессов роста и пролиферации (ангиотензин, эндотелин I, супероксидные радикалы, простациклин, С-натрийуретичеcкий пептид, оксид азота) и, наконец, в регуляции тонуса гладких мышц сосудов (эндотелин, ангиотензин II, тромбоксан А2, простациклин, эндотелиальный фактор деполяризации, оксид азота).
Центральная роль во всех этих процессах принадлежит оксиду азота (NO). Именно NO, присутствующий во всех эндотелиальных клетках, обладает наиболее выраженными сосудорасширяющими свойствами, и именно эта молекула сегодня является главной «мишенью » для фармакологической коррекции эндотелиальной дисфункции. Снижение уровня биологически активного NO, продуцируемого сосудистым эндотелием, или снижение его биодоступности считается ключевым моментом в формировании ЭД. Важнейшим звеном в цепи механизмов, ведущих к развитию дефицита NO и ЭД при многих патологиях, в том числе при ИБС и СД, является дефицит концентрации L-аргинина, которая колеблется в зависимости от возраста и диеты. В норме концентрация этой аминокислоты составляет 45–150 мкмоль/л в сыворотке крови (Boger R.H., Bode-Boger S.M., 2001).
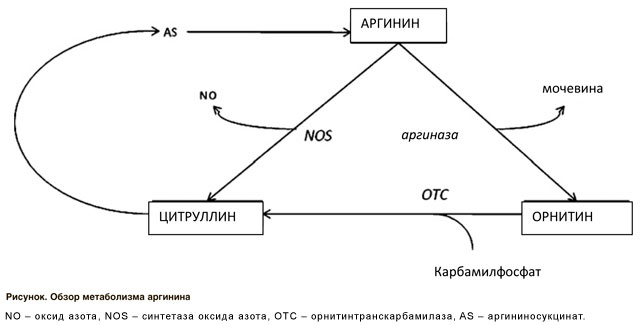
Аргинин является единственным источником для синтеза оксида азота (NO). В ходе многоступенчатой реакции с помощью NO-синтетазы (NOS) аргинин превращается в NO и цитруллин (рисунок).
Несколько исследований продемонстрировали взаимосвязь между восполнением дефицита L-аргинина и эндотелиальной функцией (Bai Y., 2009; Regensteiner J.G. et al., 2003).
Вторым ферментом, конкурирующим с NO-синтетазой за аргинин, является аргиназа, которая превращает аминокислоту в орнитин. Было продемонстрировано, что аргиназа активируется при нескольких патологических состояниях, таких как воспаление или СД (Morris C.R. et al., 2005; Romero M.J. et al., 2008). Более того, было показано, что аргинин и орнитин конкурируют за один и тот же транспортер (Closs E.I., 2002). Следовательно, снижение уровня аргинина и повышение уровня орнитина с помощью аргиназы приводит к дальнейшему снижению внутриклеточной доступности аргинина. Кроме того, низкие уровни аргинина способствуют разобщению NO-синтетазы и выработке активных форм кислорода (Xia Y., 1996). Это, в свою очередь, снижает биодоступность NO и, следовательно, ухудшает эндотелиальную функцию.
Несмотря на большое значение NO-синтетазы для эндотелиальной функции и здоровья сердечно- сосудистой системы, ее точное измерение остается диагностической проблемой, ограничивающей ее использование в клинической практике. Недавно внедренный в практику «индекс общей биодоступности аргинина» (ИОБА) (Tang W.H. et al., 2009; Morris C.R. et al., 2005) может представлять собой интересный и простой критерий оценки эндотелиальной функции. Индекс отражает не только аргинин как субстрат, но также и метаболические продукты – цитруллин и орнитин; это позволяет преодолеть неудовлетворительную прогностическую значимость оценки только уровней аргинина (Tang W.H. et al., 2009). ИОБА рассчитывается путем деления содержания аргинина на показатели содержания цитруллина и орнитина [аргинин/(цитруллин + орнитин)]. Tang и соавторы продемонстрировали наличие ассоциации ИОБА со значимым обструктивным заболеванием коронарных артерий, а также с будущими сердечно-сосудистыми событиями у 1010 пациентов, за которыми осуществлялось последующее наблюдение на протяжении 3 лет.
Особого внимания и подробного рассмотрения заслуживают результаты масштабного клинического исследования, недавно проведенного учеными из Австрии, Германии и Нидерландов (Harald Sourij et al.); его результаты были впервые опубликованы в 2011 году в журнале Atherosclerosis. В ходе этого исследованиями авторы изучили ассоциацию между ИОБА и маркерами эндотелиальной дисфункции, а также предикторы ИОБА. При его проведении использовались данные из исследования LURIC (Ludwigshafen Risk and Cardiovascular Health, Winkelmann BR et al., 2001), которое представляло собой проспективное когортное исследование, разработанное для оценки воздействия генетических полиморфизмов и плазменных биомаркеров на здоровье сердечно-сосудистой системы. В этом исследовании был осуществлен забор образцов у 3316 пациентов европеоидной расы, госпитализированных в один центр в Германии для проведения коронарной ангиографии в период с июня 1997 г. по январь 2000 г. Ишемическая болезнь сердца определялась как наличие как минимум одного сужения коронарной артерии на 50% или более. В данное исследование были включены все пациенты с наличием полных наборов доступных данных о содержании аргинина, орнитина и цитруллина. Образцы венозной крови брали натощак утром перед проведением коронарографии. В образцах сыворотки, которые быстро замораживались, определяли избранные переменные. Концентрации аргинина, орнитина и цитруллина определяли в образцах сыворотки с помощью традиционной методики анализа на содержание аминокислот. Следует подчеркнуть, что значения ИОБА сильно зависят от того, рассчитываются ли они на основании данных измерений в плазме или в сыворотке крови. Активированные тромбоциты высвобождают аргинин и орнитин, следовательно, концентрации аргинина в плазме примерно на 40%, а концентрации орнитина примерно на 10% ниже, чем в сыворотке (Teerlink T. et al., 2003, а также личные данные A. Meinitzer). Между плазменными и сывороточными концентрациями цитруллина значимое различие отсутствует. Следовательно, показатели ИОБА, рассчитанные по уровням аминокислот, измеренных в сыворотке, в среднем на 35% выше, чем таковые в ЭДТА- плазме. Для расчета ИОБА авторы исследования использовали концентрации в сыворотке.
Индекс общей биодоступности аргинина рассчитывался путем деления содержания аргинина на сумму концентраций орнитина и цитруллина. Соотношение аргинина к оринитину, которое может отражать активность аргиназы, рассчитывалось путем деления уровней аргинина на уровни орнитина.
Информацию о смертности получали из местных регистров.
С целью классифицировать умерших на тех, кто умер от сердечно-сосудистых причин, и тех, кто умер от причин, не связанных с сердечно-сосудистой патологией, использовалась информация из свидетельств о смерти. Эта классификация была выполнена двумя опытными клиницистами, которые не были осведомлены о любых данных об участниках исследования за исключением уже упомянутой информации, которая требовалась для классификации причин смерти. При расхождении во мнениях или неуверенности в причине смерти решение принималось главным исследователем исследования LURIC. Восемнадцать пациентов не были доступны для контакта в период последующего наблюдения, а в отношении 23 умерших не было достаточной информации для классификации причины смерти.
Сахарный диабет 2-го типа диагностировали у пациентов с уровнем глюкозы плазмы натощак (ГПН) ≥126 мг/дл или с наличием в анамнезе установленного СД в соответствии с критериями Всемирной организации здравоохранения (ВОЗ) [14].
Что касается статистического анализа, исследуемая популяция была стратифицирована в соответствии с квартилями ИОБА или квартилями соотношения аргинина к орнитину.
ИОБА оценивался в случайной выборке исследования LURIC, состоявшей из 2236 пациентов (668 женщин и 1568 мужчин). Исходные характеристики, указанные в соответствии с квартилями ИОБА, представлены в таблице 1.
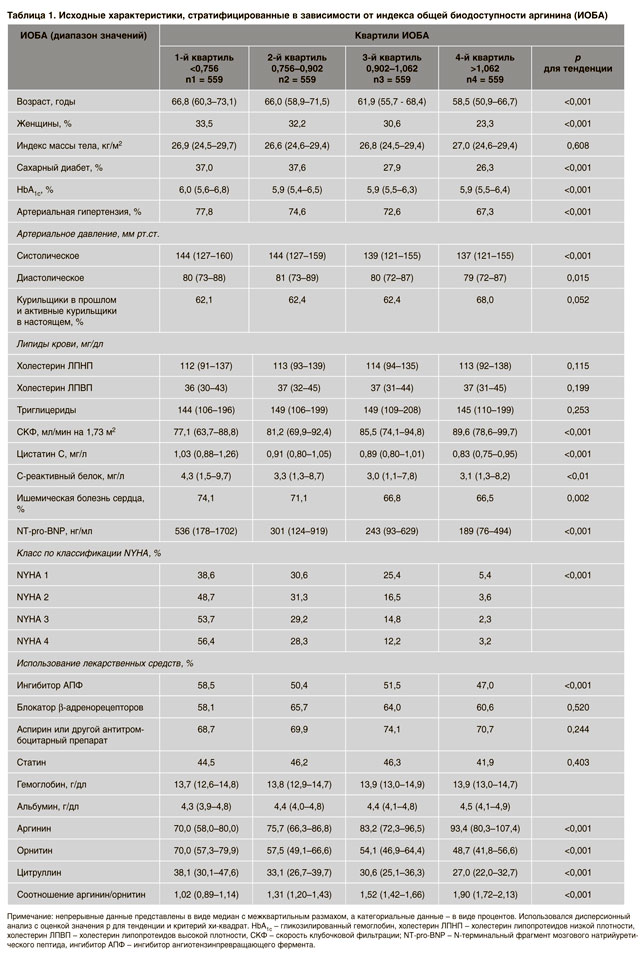
Очевидно, что пациенты в меньших квартилях ИОБА были старше и имели худший профиль сердечно-сосудистого риска; также у них отмечалась более высокая частота артериальной гипертензии (77,8% в сравнении с 74,6%, 72,6% и 67,3% во 2-м, 3-м и 4-м квартиле соответственно) и СД 2-го типа (37,0% в сравнении с 37,6%, 27,9% и 26,3%). Более того, скорость клубочковой фильтрации (СКФ) увеличивалась параллельно квартилям ИОБА, в то время как уровень мозгового натрийуретического пептида (BNP) снижался (p для тенденции <0,001 для обоих показателей). При одномерном регрессионном анализе ИОБА отрицательно коррелировал с возрастом, наличием СД, средним диастолическим давлением и pro-BNP; положительно – с СКФ (р для всех <0,05). Было выявлено отсутствие значимых корреляций с полом, наличием ИБС, курением, холестерином ЛПНП, уровнями триглицеридов, СРБ или средним систолическим артериальным давлением.
При многовариантном регрессионном анализе ИОБА демонстрировал независимую и обратную ассоциацию с возрастом (β=−0,160, p<0,001), NT-pro-BNP (β=−0,155, p<0,001), средним диастолическим артериальным давлением (β=−0,048, p=0,017) и наличием СД (β=−0,042, p=0,04), а положительную ассоциацию – с холестерином ЛПВП (β=0,041, p=0,043).
Также в ходе этого исследования была проанализирована корреляция ИОБА с известными биохимическими маркерами ЭД – молекулой межклеточной адгезией 1 (ICAM-1), молекулой сосудистой адгезии 1 (VCAM-1) и антигеном фактора Виллебранда (vWF-Ag). Индекс общей биодоступности аргинина демонстрировал обратную и достоверную корреляцию с этими маркерами (r=−0,136, p<0,001 для ICAM-1 и r=−0,154, p<0,001 для vWF-Ag). Самая сильная корреляция была выявлена с VCAM-1 (r=−0,301, p<0,001). При формировании квартилей ИОБА наблюдалось достоверное снижение ICAM-1, VCAM-1 и vWF-Ag от 1-го к 4-му квартилю (p для тенденции <0,001 для всех показателей; табл. 2).
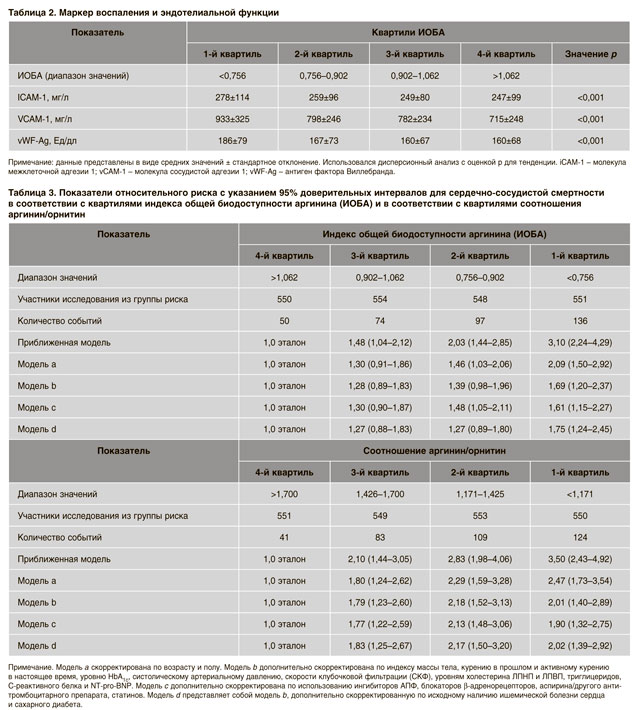
Что же касается взаимосвязи между ИОБА, соотношением аргинин/орнитин и сердечно-сосудистой смертностью, ее анализ был выполнен путем разделения популяции на квартили ИОБА и соотношения аргинин/ орнитин соответственно. Наблюдалось непрерывное увеличение сердечно-сосудистой смертности по мере снижения квартиля ИОБА (табл. 3). В целом, в исследуемой популяции умерли 560 пациентов, среди них смерть от сердечно-сосудистых причин была констатирована в 357 (64%) случаях.
В приближенной модели показатели относительного риска (ОР) составляли 1,48 (1,04–2,21), 2,03 (1,44– 2,85) и 3,10 (2,24–4,29) для 3-го, 2-го и 1-го квартиля соответственно в сравнении с 4-м квартилем (эталон).
Даже после полной коррекции по возрасту, полу, индексу массы тела, курению, уровню HbA1c, систолическому артериальному давлению, скорости клубочковой фильтрации, уровням холестерина ЛПНП и холестерина ЛПВП, триглицеридов, С-реактивного белка, NT-proBNP, исходному наличию ИБС и/или СД, показатель ОР для 1-го квартиля оставался статистически значимым (скорректированный ОР 1,75 (1,24–2,45)).
При выполнении такого же анализа для соотношения аргинин/орнитин ассоциация была даже более сильной. Скорректированные показатели ОР составляют 1,83 (1,25–2,67), 2,17 (1,50–3,20) и 2,02 (1,39–2,92) для 3-го, 2-го и 1-го квартиля соответственно (табл. 3). Дальнейший анализ был выполнен для каждой из трех аминокислот с целью установить, имеют ли они прогностическое значение сами по себе (табл. 4).
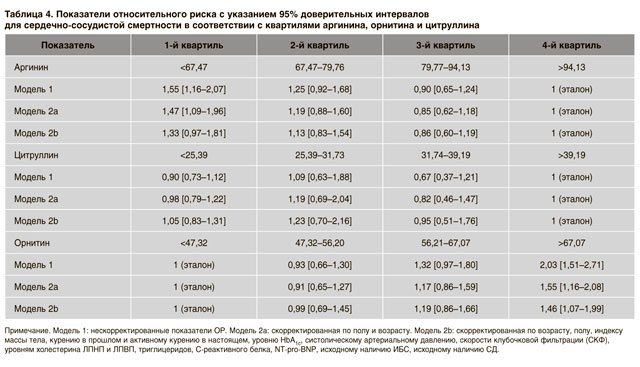
Аргинин был ассоциирован с незначительным повышением сердечно-сосудистой смертности в 1-м квартиле по сравнению с 4-м в приближенной модели (HR 1,55 (1,16– 2,07)) и после коррекции по возрасту и полу (скорректированный ОР 1,47 (1,09–1,96)), но эта ассоциация теряла значимость в полностью скорректированной модели. Цитруллин не нес никакой прогностической информации, тогда как орнитин ассоциировался с повышенным риском сердечно-сосудистой смертности даже после полной коррекции (скорректированный ОР 1,46 (1,07–1,99)). Наконец, была рассчитана регрессионная модель Кокса, включающая аргинин и 1/(цитруллин+ орнитин) в качестве непрерывных переменных и ИОБА сам по себе. ИОБА являлся единственным показателем, в отношении которого было доказано, что он имеет достоверное прогностическое значение для будущих сердечно-сосудистых событий (p<0,001). При включении в модель Кокса соотношения аргинин/орнитин после коррекции для аргинина и орнитина только соотношение достоверно ассоциировалось с сердечно-сосудистой смертностью. (p<0,001).
Таким образом, в данном исследовании в крупной когорте пациентов, направленных на коронарную ангиографию, было продемонстрировано, что низкие уровни ИОБА, а также соотношение аргинин/орнитин выражено ассоциированы с сердечно-сосудистой смертностью. ИОБА был достоверно снижен у пациентов с СД 2-го типа и был обратно ассоциирован с биохимическими маркерами эндотелиальной дисфункции. Более того, наличие обоих заболеваний (ИБС и СД 2-го типа) не сопровождалось меньшим значением ИОБА в сравнении с пациентами с СД 2-го типа и отсутствием ангиографических доказательств ИБС.
Это наблюдение находится в соответствии и расширяет данные Tang и соавторов (2009), которые смогли продемонстрировать ассоциацию ИОБА со значимыми сердечно- сосудистыми событиями и общей смертностью в когорте из 1010 участников, которым проводилась элективная коронарная ангиография. Однако в этом исследовании сообщалось об отсутствии данных о сердечно- сосудистой смертности, вероятно, из-за ограниченного количества событий. Авторы в дальнейшем показали значительное увеличение распространенности обструктивной ИБС по мере снижения ИОБА, но данные не были скорректированы по наличию диабета. Однако, как и в предшествующем исследовании, показавшем, что СД 2-го типа чаще встречается у пациентов со значимой ИБС (Saely C.H., 2008), Tang и соавторы также документально зафиксировали в 3 раза большую распространенность СД в группе пациентов с обструктивной ИБС.
Соответственно, в ходе данного исследования в когорте LURIC была выявлена значимая обратная ассоциация между квартилями ИОБА и ИБС (как минимум 1 стеноз >50%) также в приближенной логистической модели. Однако эта ассоциация теряет свою значимость после коррекции по наличию диабета. Таким образом, низкий ИОБА может рассматриваться как связующий элемент в ассоциации СД 2-го типа и ИБС. Равным образом было показано, что СД является независимым предиктором ИОБА: пациенты с диагнозом СД 2-го типа имели достоверно меньшее значение ИОБА, чем пациенты без диабета (0,88±0,23 в сравнении с 0,94±0,24, p<0,001), в то время как (что интересно) наличие ИБС не имело достоверного прогностического значения для ИОБА (в качестве непрерывной переменной) при одномерном анализе.
Пациенты, которым проводится ангиография, представляют собой популяцию промежуточного и высокого риска. ИОБА или соотношение аргинин/орнитин являются многообещающими маркерами для выявления пациентов с особенно высоким риском, у которых должна рассматриваться возможность даже более интенсивной коррекции факторов сердечно-сосудистого риска. Кроме того, дополнительное применение L-аргинина может улучшать прогноз путем повышения уровня L-аргинина как субстрата для NO-синтетазы. Недавний мета-анализ исследований по оценке краткосрочного дополнительного применения аргинина свидетельствовал в пользу его дополнительного введения в организм для улучшения поток-опосредованного расширения (ПОР) плечевой артерии (Bai Y. et al., 2009). Более того, авторы мета-анализа указывали на то, что это улучшение может быть особенно выраженным у пациентов с низким исходным ПОР. Если сфокусироваться на исследованиях, включавших пациентов с наличием только ИБС, то три исследования продемонстрировали благоприятный эффект дополнительного применения аргинина (Adams M.R. et. al., 1997; Maxwell A.J. et al., 2002; Yin W.H. et al., 2005), тогда как только одно исследование – нет (Blum A. et al., 2000). Кроме того, также имеются доказательства благоприятного влияния дополнительного применения аргинина у пациентов с СД 2-го типа (Lubec B. et. al., 1997; Lucotti P. et al., 2009). Однако существует необходимость в проведении дальнейших исследований, проясняющих эту потенциальную терапевтическую концепцию.
Таким образом, данные, полученные в ходе описанного выше исследования, демонстрируют прогностический потенциал коэффициентов биодоступности аргинина (индекса общей биодоступности аргинина, а также соотношения аргинин/орнитин) в популяции лиц с подозреваемой ИБС. Более того, было показано, что СД 2-го типа ассоциирован с низкими значениями ИОБА. Влияние коррекции факторов кардиоваскулярного риска на значения ИОБА и его вероятное преобразование в снижение сердечно-сосудистой смертности и частоты сердечно-сосудистых событий, очевидно, нуждается в прояснении в ходе будущих интервенционных исследований.
Клинические аспекты дополнительного применения L-аргинина
Вопрос о том, как увеличить синтез NO эндотелиоцитами и повысить его биодоступность, сегодня не зря относится к числу одних из самых важных в кардиологии и ангиологии: ведь таким способом можно будет попытаться разорвать порочный круг прогрессирования атеросклероза и восстановить сосудистый гомеостаз, нарушенный у всех без исключения пациентов с заболеваниями, в основе которых лежит ЭД. Восполнить резерв L-аргинина как незаменимого субстрата для синтеза NO в организме пациента с патологией, в основе которой лежит атеросклероз, усилить NO-опосредованную эндотелийзависимую вазодилатацию периферических артерий, а значит – улучшить клиническое состояние и замедлить темпы прогрессирования поражения сосудов, сегодня можно с помощью курсового применения в составе комплексной терапии отечественного препарата L-аргинина Тивортин®. К основным фармакологическим эффектам препарата Тивортин®, обусловливающим его вазодилататорную и ангиопротекторную активность, можно отнести:
- •
- способность восстанавливать эндотелийзависимую вазодилатацию при атеросклерозе;
- •
- стимуляцию синтеза оксида азота – L-аргинин является субстратом для NО-синтазы
(фермента, который катализирует синтез оксида азота в эндотелиоцитах); - •
- уменьшение адгезии лейкоцитов и тромбоцитов к эндотелию;
- •
- уменьшение агрегации тромбоцитов;
- •
- ингибирование синтеза эндотелина-I, который является мощным вазоконстриктором и стимулятором
пролиферации и миграции гладкомышечных клеток сосудистой стенки; - •
- способность угнетать синтез протеинов адгезии VCAM-1 и MCP-1, предотвращая таким образом образование и
развитие атеросклеротических бляшек; - •
- антиоксидантное действие.
Благодаря столь широкому спектру фармакологической активности, включающему в первую очередь стимуляцию синтеза NO, Тивортин® является высокоэффективным эндотелиопротектором, замедляющим прогрессирование атеросклероза. В настоящее время к числу основных показаний к клиническому применению этого препарата относят атеросклероз коронарных и церебральных сосудов сердца, а также атеросклероз периферических сосудов.
Тивортин® выпускается в лекарственной форме для парентерального применения (раствор для инфузий) и в форме раствора для перорального применения Тивортин® аспартат с удобным дозированием (1 мерная ложка – 1 г препарата). Это позволяет применять Тивортин® в комплексном лечении пациентов как на этапе стационарного лечения, так и в амбулаторной практике. Раствор для инфузий Тивортин® вводится внутривенно капельно со скоростью 10 капель в минуту в первые 10–15 минут, потом скорость введения можно увеличить до 30 капель в минуту (суточная доза препарата – 100 мл раствора). При пероральном применении Тивортин® аспартат принимают по 5 мл (1 мерная ложка) во время еды 3–8 раз в сутки (максимальная суточная доза – 8 г).
Таким образом, коррекция ЭД в настоящее время является одним из важных элементов системной этиопатогенетической стратегии лечения атеросклеротического поражения сосудов, в том числе коронарных. В качестве практического инструмента реализации данной терапевтической стратегии по праву может рассматриваться назначение в составе комплексной терапии незаменимого донатора оксида азота L-аргинина (Тивортин®).
Список литературы находится в редакции
Кардіопротекторний ефект донатора оксиду азоту в пацієнтів з артеріальною гіпертензією
Резюме: Останнє десятиліття ознаменувалося інтенсивним розвитком фундаментальних та клінічних досліджень щодо ролі судинного ендотелію в ґенезі серцево-судинних захворювань (ССЗ). Сьогодні увага дослідників прикута до вивчення ролі дисфункції ендотелію (ДЕ) в патогенезі ССЗ, а також до пошуку способів її ефективної корекції. В статті наводяться дані міжнародних і українських публікацій щодо можливого кардіопротекторного ефекту донатора оксиду азоту […]
ЗДОРОВ’Я НЕФРОНА — ЗАПОРУКА СТАБІЛЬНОГО АРТЕРІАЛЬНОГО ТИСКУ
Хронічна хвороба нирок (ХХН) є однією з найбільш поширених проблем у системі охорони здоров’я з тяжкими соціальними й економічними наслідками. Ця гетерогенна група захворювань об’єднує будь-які порушення нормальної структури й функції нирок з подальшим виникненням ниркових і позаниркових розладів, що мають несприятливий вплив на більшість систем організму. Важливою проблемою в усьому світі на сьогодні є […]
