Опосредованная L-аргинином реактивность сосудов у пациентов с риском развития инсульта
Опосредованная L-аргинином реактивность сосудов у пациентов с риском развития инсульта
Резюме
Цели. L-аргинин является субстратом для синтеза оксида азота (NO) и, как было установлено, приводит к эндотелийзависимому увеличению кровотока в сосудах головного мозга человека. Мы проверили гипотезу о нарушении L-аргининопосредованной реактивности сосудов у пациентов с сердечно-сосудистыми (СС) факторами риска и риском развития инсульта.
Методы. В исследование включили 55 пациентов с СС факторами риска (средний возраст составил 63±8,5 года). 45 пациентов ранее перенесли малый инсульт или транзиторную ишемическую атаку (ТИА), а у 10 пациентов были выявлены только СС факторы риска, но в анамнезе отсутствовали события, связанные с ишемией сосудов головного мозга. Эндотелийзависимые изменения церебрального кровотока при внутривенном введении 30 г L-аргинина оценивали посредством непрерывной транскраниальной допплерографии обеих средних мозговых артерий (СМА), а толщину комплекса интима-медиа (ТКИМ) общей сонной артерии — с помощью дуплексного ультразвукового сканирования. Связь между факторами риска, ТКИМ, L-аргининопосредованной реактивностью сосудов и предшествующими сосудистыми событиями анализировали с помощью поэтапного множественного регрессионного анализа с использованием линейных моделей, а также выполнили сравнение групп пациентов.
Результаты. У здоровых молодых добровольцев отмечено L-аргининопосредованное увеличение средней скорости кровотока на 22±8%; у 55 пациентов — на 28±10%. У пациентов с инсультом или ТИА в анамнезе отмечен статистически значимо более выраженный прирост скорости кровотока в ответ на введение L-аргинина — на 29±10% по сравнению с пациентами с СС факторами риска, но без цереброваскулярных событий в анамнезе (21±8%, p<0,05). Результаты поэтапного множественного регрессионного анализа с использованием линейных моделей указывают на наличие статистически значимой связи между повышенной реактивностью сосудов при введении L-аргинина и наличием инсульта/ТИА (p<0,001), а также повышенными уровнями фибриногена (p<0,05) в анамнезе. Но следует отметить, что такой связи не наблюдали для возраста, ТКИМ, артериальной гипертензии (АГ), уровня холестерола (ХС) в сыворотке крови и других факторов риска. С помощью этой же регрессионной модели была установлена связь между ТКИМ и инсультом/ТИА в анамнезе (p<0,001), а также уровнями ХС в сыворотке крови (p<0,05), но не отмечено связи с L-аргининопосредованной реактивностью сосудов.
Выводы. L-аргининопосредованную реактивность сосудов головного мозга можно оценить с помощью допплерографии. В исследовании отмечено повышение этого показателя у пациентов с инсультом или ТИА в анамнезе. L-аргининопосредованная реактивность сосудов не зависела от ТКИМ сонных артерий. Мы пришли к заключению, что повышенная реактивность сосудов при введении L-аргинина является потенциальным маркером эндотелиальной дисфункции сосудов головного мозга и независимым признаком повышенного риска развития инсульта.
Введение
Установлено, что дисфункция эндотелия коронарных артерий ассоциируется с повышенным риском развития СС событий, таких как инфаркт миокарда (ИМ) и нестабильная стенокардия [1, 2]. Существует небольшой объем клинических данных о роли эндотелиальной дисфункции сосудов головного мозга и ее прогностического значения в отношении развития цереброваскулярных событий. Сосудистые факторы риска, такие как АГ, сахарный диабет (СД), дислипидемия и/или курение ассоциированы не только с повышенным СС риском, но и с риском развития инсульта и, как известно, способствуют атеросклеротическим изменениям и развитию эндотелиальной дисфункции в коронарных, а также церебральных и экстрацеребральных сосудах [3, 4]. В настоящее время надежные маркеры, позволяющие оценить функциональное состояние церебральных сосудов у пациентов с риском развития инсульта отсутствуют. Как известно, изменение уровней некоторых показателей, таких как фактор Виллебранда (ФВ), фактор VIII, фибриноген, C-реактивный белок (С-РБ), гомоцистеин и количество лейкоцитов ассоциируется с повышенным риском развития инсульта, хотя прогностическое значение этих показателей не высоко (относительный риск 1,81–1,26) [5, 6]. Определение ТКИМ общих сонных артерий стало признанным методом оценки ранних атеросклеротических изменений внечерепных артерий, при этом утолщение комплекса, как известно, ассоциируется с повышенным риском развития инсульта [7, 8].
Если говорить о коронарном кровообращении, то в нескольких проспективных исследованиях показано, что у пациентов c риском поражения коронарных артерий выявлено местное снижение продукции NO, повышение сосудистого тонуса и снижение вазодилатационной способности сосудов вследствие недостаточного количества эндогенного NO [9, 10]. После местного введения ацетилхолина, который стимулирует выработку NO, стенки сосудов у таких пациентов расслабляются недостаточно, но эта функция может быть нормализована или повышена с помощью применения экзогенного L-аргинина [11]. В нескольких исследованиях было установлено, что у пациентов с СС факторами риска, атеросклерозом и ишемической болезнью сердца биологическая активность NO и вазодилатационная способность снижены как в периферических, так и в коронарных артериях [12–15]. L-аргининопосредованная вазодилатация положительно коррелирует с тяжестью стеноза коронарных артерий [16]. Что касается реактивности сосудов, опосредованной L-аргинином, и эндотелиальной функции сосудов головного мозга, то в этом случае клинические данные ограничены, поскольку указанные параметры невозможно проверить посредством местного введения ацетилхолина или L-аргинина. В исследованиях с использованием позитронно-эмиссионной томографии (ПЭТ) было выявлено, что эндотелиальную функцию сосудов головного мозга можно оценить с помощью системного введения L-аргинина, который является субстратом для эндотелиальной NO-синтазы, обусловливая локальное увеличение количества NO, активацию циклического гуанозинмонофосфата (цГМФ), расслабление гладкой мускулатуры стенок сосудов и вазодилатацию [17–19]. Вазодилатация мозговых резистивных сосудов (сосудов сопротивления) приводит к увеличению средней скорости кровотока (ССК) в крупных сосудах, которую можно оценить с помощью транскраниальной допплерографии [20].
Целью данного исследования было определить, меняется ли эндотелиальная функция церебральных сосудов, оцениваемая по реакции на L-аргинин, в зависимости от установленных факторов риска развития инсульта. Наиболее весомым фактором риска развития инсульта, более важным, чем АГ или СД, являлся недавно перенесенный инсульт или ТИА [21]. Таким образом, реактивность сосудов в ответ на введение L-аргинина сравнивали в группе пациентов высокого риска, недавно перенесших инсульт или ТИА, и в группе пациентов первичной профилактики, у которых были выявлены известные факторы риска, но отсутствовал инсульт в анамнезе.
Пациенты и методы
Данное исследование является частью исследовательской программы немецкого сообщества по борьбе с инсультом («Kompetenznetz Schlaganfall»), цель которого состоит в определении новых признаков риска развития инсульта и разработке терапевтических подходов к лечению при данном заболевании. Протокол исследования включает данные о периоде, в течение которого проводили набор пациентов, о периоде наблюдения (5 лет), о времени повторной оценки эндотелиальной функции и регистрации СС событий (ишемического инсульта, ТИА, ИМ, госпитализации по поводу сосудистого события). В период набора участников в исследование проводили выявление здоровых добровольцев и пациентов в соответствии с имеющимися у них СС факторами риска. В дополнение к группе из 20 здоровых добровольцев, у которых не обнаружили ни одного известного СС фактора риска посредством установленных методов (средний возраст 32,9±5,9 года, 8 мужчин, 12 женщин), в исследование последовательно включили 55 пациентов (средний возраст 63,0±8,5 года) с СС факторами риска, которые посещали амбулаторное отделение нашей больницы в рамках контрольных медицинских осмотров. У 45 пациентов в анамнезе были отмечены цереброваскулярные события (ишемический инсульт или ТИА) за 2–52 нед до включения в исследование (группа инсульта в анамнезе), тогда как у 10 пациентов отмечали только СС факторы риска без цереброваскулярных событий в прошлом (группа СС риска). Пациентов с признаками поражения крупных интракраниальных и экстракраниальных артерий, обнаруженных с помощью дуплексного ультразвукового сканирования в соответствии с критериями TOAST [22], исключали из исследования, поскольку интерес специалистов был направлен на изучение ранних эндотелиальных и атеросклеротических изменений в сосудах. Исследование проводили в соответствии с принципами Хельсинкской декларации [23]. Протокол исследования был одобрен этическим комитетом медицинского факультета Мюнхенского университета Людвига-Максимилиана (Ludwig Maximilian University of Munich; проект № 104/00). Все пациенты и здоровые добровольцы предоставили письменное информированное согласие.
СС факторы риска оценивали по стандартной процедуре, которая включала сбор анамнеза, клинический осмотр, лабораторные анализы и электрокардиографическое исследование в соответствии с подходом к оценке риска развития инсульта, определенном в исследовании Copenhagen City Heart Study (CCHS) [24]. Лабораторные анализы включали определение уровней ХС, триглицеридов, липопротеинов низкой плотности, глюкозы, гликированного гемоглобина (HbA1с), фибриногена и C-РБ. ФВ ≥80%, фактор VIII ≥80% и C-РБ ≥150% использовали в качестве маркеров повышенного риска развития инсульта.
L-аргининопосредованную реактивность сосудов и ТИМ определяли с помощью стандартной методики допплерографии/дуплексного ультразвукового сканирования: величину скорости кровотока в СМА, определяемую посредством транскраниальной допплерографии, часто используют для оценки кровотока в сосудах головного мозга, если стеноз этой артерии был исключен [25]. В соответствии с протоколами ранее опубликованных исследований [20], изменения скорости кровотока в СМА в ответ на внутривенное введение в локтевую вену L-аргинина (0,5 г/кг массы тела) непрерывно измеряли в течение как минимум 45 мин с помощью двусторонней допплерографии. 30г L-аргинина гидрохлорида (Fresenius Kabi, Германия) разводили в 500 мл физиологического раствора и вводили внутривенно в течение 30 мин.
Мониторинг допплеровских сигналов с двух сторон (Multidop X2, DWL, Германия), показателей артериального давления (АД), частоты пульса (N-Cat Monitoring Unit, Nellcor, Япония) и концентрации CO2 в конечной порции выдыхаемого воздуха (DWL, Германия) осуществляли непрерывно и регистрировали с помощью программного обеспечения для аппаратов транскраниальной допплерографии, версия 7 (DWL, Германия). С целью подтвердить, что L-аргинин используется эндотелиальной NO-синтазой, проводили измерение уровня побочного продукта реакции — L-цитруллина с помощью высокоэффективной жидкостной хроматографии в плазме крови 19 пациентов до и после введения L-аргинина.
ТКИМ правой и левой общих сонных артерий оценивали посредством экстракраниального дуплексного ультразвукового сканирования на частоте 7,5 МГц в B-режиме (HDI 3000, ATL, Германия), ее определяли по задней стенке общей сонной артерии на 1–2 см ниже бифуркации [8].
Результаты представлены в виде среднего±стандартное отклонение.
Среднее значений (полученных с правой и левой сторон), отражающих изменения скорости кровотока в СМА и ТКИМ использовали для статистических сравнений групп пациентов. Различия между группами анализировали, используя U-критерий Манна – Уитни и t-критерий, если значения лабораторных исследований характеризовались нормальным распределением. Поэтапный множественный регрессионный анализ с использованием линейных моделей применяли для определения факторов, которые влияли на реактивность сосудов в ответ на введение L-аргинина и на ТКИМ. Модель для оценки связи между данными, полученными при допплерографии, и СС факторами риска включала следующие параметры: возраст пациента, наличие цереброваскулярных событий в анамнезе, ТКИМ, АД, статус в отношении курения, СД, уровень ХС и фибриногена. τ-критерий Кендалла использовали для определения корреляции между сосудистыми изменениями и СС факторами риска.
Результаты
Здоровые добровольцы
Максимальное увеличение ССК во время введения L-аргинина составило 22±9% у здоровых лиц. 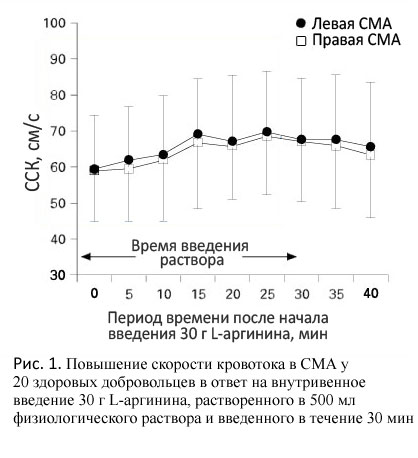 Какие-либо статистически значимые различия в изменениях кровотока с обеих сторон, АД, частоты сердечных сокращений и концентрации CO2 в конечной порции выдыхаемого воздуха в ответ на введение L-аргинина отсутствовали. Среднее увеличение скорости кровотока сохранялось в течение 30-минутного введения L-аргинина (рис. 1). Для воспроизводимости результатов измерения у 2 испытуемых выполнили дважды в разные дни с перерывами в несколько дней между ними. Изменения ССК в 1-й и 2-й день у одного испытуемого составили 19 и 21%, и 20 и 18% соответственно — у другого.
Какие-либо статистически значимые различия в изменениях кровотока с обеих сторон, АД, частоты сердечных сокращений и концентрации CO2 в конечной порции выдыхаемого воздуха в ответ на введение L-аргинина отсутствовали. Среднее увеличение скорости кровотока сохранялось в течение 30-минутного введения L-аргинина (рис. 1). Для воспроизводимости результатов измерения у 2 испытуемых выполнили дважды в разные дни с перерывами в несколько дней между ними. Изменения ССК в 1-й и 2-й день у одного испытуемого составили 19 и 21%, и 20 и 18% соответственно — у другого.
Пациенты
Всего было обследовано 55 пациентов с СС факторами риска (табл. 1).
Таблица 1. Характеристики и профиль СС факторов риска 45 пациентов, перенесших инсульт/ТИА в сравнении с данными 10 пациентов без цереброваскулярных событий в анамнезе
| СС факторы риска | Пациенты с инсультом/ТИА в анамнезе (n=45) |
Пациенты без цереброваскулярных событий в анамнезе (n=10) |
| Возраст, лет | 63,9±8,2 | 58,6±6,5 |
| Продолжительность АГ, лет | 6,3±8,2 | 9,5±11,4 |
| Систолическое АД, мм рт. ст. | 144,5±20,3 | 143,4±23,0 |
| Количество наименований антигипертензивных ЛС, принимаемых пациентом |
1,3±1,1 | 1,7±1,3 |
| HbA1c, % | 5,64±0,76 | 5,51±0,87 |
| ХС, мг/дл | 209±40 | 226±40 |
| Фибриноген, мг/дл | 351±87 | 387,6±95 |
| Курящие, % | 18 | 20 |
| Гипертрофия левого желудочка сердца, % | 18 | 10 |
| ИБС, % Стенокардия ИМ |
11 11 |
20 20 |
| Цереброваскулярные события, % Малый инсульт ЗОИНД ТИА |
27 37 37 |
0 |
| Баллы по шкале риска развития инсульта CCHS |
14,9±8,6 | 11,6±4,5 |
| Лечение статинами, % | 47 | 40 |
| Антитромбоцитарная/антикоагулянтная терапия, % АСК Клопидогрел/тиклопидин Варфарин*/гепарин Терапию не получали |
51 27 18 2 |
60
40 |
| ЛС — лекарственное средство, ЗОИНД — затянувшийся обратимый ишемический неврологический дефицит, АСК — ацетилсалициловая кислота. *В оригинальной статье применен термин «кумадины» («coumadins») (Прим.ред.). | ||
Двустороннее экстракраниальное дуплексное ультразвуковое сканирование выполнили 54 пациентам, а двустороннюю транскраниальную допплерографию во время внутривенной инфузии L-аргинина — 49 пациентам. У 4 пациентов СМА была недоступна для оценки через костное ультразвуковое «окно» и с одной, и с другой стороны, а двум пациентам с внутричерепным стенозом СМА тест на L-аргининопосредованную реактивность сосудов не проводили.
ТКИМ общих сонных артерий составила 0,92±0,21 мм с правой стороны и 0,97±0,25 с левой. L-аргининопосредованная вазодилатация была сходной в правой и левой СМА (26±12 и 29±14% соответственно). Концентрацию L-цитруллина определили у 19 пациентов до и после введения L-аргинина; отмечено повышение концентрации с 292±140 моль/л до 357±86 моль/л.
Была установлена связь между повышенной реактивностью сосудов в ответ на введение L-аргинина и цереброваскулярными событиями в анамнезе (p<0,001), а также повышенным уровнем фибриногена (p<0,05), однако не обнаружено связи между L-аргининопосредованной реактивностью сосудов и ТКИМ или другими СС факторами риска. В то же время регрессионный анализ показал наличие статистически значимой связи между ТКИМ и цереброваскулярными событиями в анамнезе (p<0,001), а также уровнем ХС (p<0,05). Не установлено связи между ТКИМ и реактивностью сосудов, опосредованной L-аргинином, а также каким-либо другим фактором риска.
У пациентов с уровнем фибриногена >400 мг/дл (n=9) L-аргининопосредованная скорость кровотока была статистически значимо выше по сравнению с таковой у пациентов с нормальным уровнем фибриногена (35±10% по сравнению с 28±9%, p<0,05). У этих пациентов также отмечены более высокие значения ТИМ (1,11±0,23 мм по сравнению с 0,95±0,20 мм, p<0,05) и повышенный уровень C-РБ (1,5±0,8 мг/дл по сравнению с 1,0±0,4 мг/дл, p<0,05) по сравнению с пациентами с нормальным уровнем фибриногена.
Корреляция между L-аргининопосредованной реактивностью сосудов и уровнем фибриногена была слабой (r=0,396, p=0,01). Других перекрестных корреляций между маркерами повышенного риска развития инсульта, таких как ФВ, фактор VIII, C-РБ и количество лейкоцитов или ранние атеросклеротические изменения по данным допплерографии или дуплексного ультразвукового сканирования, отмечено не было.
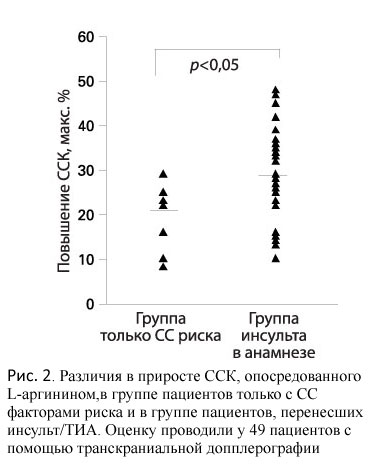 При сравнении пациентов группы инсульта в анамнезе с пациентами группы только СС риска (без инсульта в анамнезе) было выявлено статистически значимое различие в степени вазодилатации, опосредованной L-аргинином: ССК возросла на 29±10% в группе инсульта в анамнезе по сравнению с 21±8% в группе только СС риска (p<0,05) (рис. 2). Также в группе инсульта в анамнезе были отмечены статистически значимо более высокие значения ТКИМ (0,98±0,21 мм) по сравнению с таковыми в группе только СС риска (0,84±0,13 мм, p<0,05), хотя других статистически значимых различий относительно возраста или профиля факторов риска между двумя группами отмечено не было.
При сравнении пациентов группы инсульта в анамнезе с пациентами группы только СС риска (без инсульта в анамнезе) было выявлено статистически значимое различие в степени вазодилатации, опосредованной L-аргинином: ССК возросла на 29±10% в группе инсульта в анамнезе по сравнению с 21±8% в группе только СС риска (p<0,05) (рис. 2). Также в группе инсульта в анамнезе были отмечены статистически значимо более высокие значения ТКИМ (0,98±0,21 мм) по сравнению с таковыми в группе только СС риска (0,84±0,13 мм, p<0,05), хотя других статистически значимых различий относительно возраста или профиля факторов риска между двумя группами отмечено не было.
Среди пациентов, перенесших инсульт, статистически значимых различий между сосудами, находящимися на пораженной и интактной стороне, отмечено не было: прирост ССК в сосудах на стороне поражения составлял 30±13% в случае, если цереброваскулярное событие произошло в бассейне СМА (n=26), тогда как в сосудах с интактной стороны прирост ССК составил 29±11%. В группе пациентов без каких-либо сосудистых событий в анамнезе L-аргининопосредованную вазодилатацию >20% наблюдали в одной трети обследованных СМА (n=18), при этом максимальное увеличение — на 44% — было отмечено у одного пациента. В отличие от этого, у пациентов с цереброваскулярными событиями в анамнезе вазодилатацию >20% обнаружили в 79% обследованных сосудов. Таким образом, из 92 обследованных СМА в 73 артериях прирост ССК составил >20%; максимальный прирост — 61% обнаружили у одного пациента.
Обсуждение
Основными результатами данного исследования были следующие: L-аргинин приводит к увеличению ССК в СМА как у здоровых добровольцев, так и у пациентов с риском развития инсульта, что подтверждается данными транскраниальной допплерографии, и этот эффект статистически значимо более выражен у пациентов с анамнезоминсульта или ТИА. G. Micieli et al. [20] обнаружили, что введение L-аргинина в дозе 500 мг/кг массы тела в течение 30 мин приводит к увеличению скорости церебрального кровотока на 18±9% в СМА у здоровых добровольцев. У 20 пациентов с односторонним стенозом внутренней сонной артерии L-аргининопосредованная реактивность сосудов составила 23±7% в исходном периоде и 22±10% через 3 мес после хирургического вмешательства [26]. Результаты исследований у здоровых добровольцев с использованием ПЭТ свидетельствуют о том, что введение L-аргинина приводит к увеличению скорости кортикального и субкортикального церебрального кровотока на 14–16% от исходных уровней, что ассоциируется с повышением концентрации L-цитруллина в плазме крови — побочного продукта, образующегося при синтезе NO, а также с увеличением экскреции цГМФ с мочой (является вторичным посредником для NO) [17, 18]. Несмотря на то, что механизмы L-аргининопосредованной вазодилатации, не зависящие от функции эндотелия, были описаны в литературе [27], данные о повышении концентрации L-цитруллина и цГМФ четко указывают на зависимый от эндотелия и NO путь реакции сосудов на L-аргинин [18].
Поскольку при проведении прямого фармакологического исследования посредством введения ацетилхолина в церебральные артерии пациент подвергается неоправданному риску, обусловленному катетерной ангиографией, нами была предпринята попытка использовать реакцию сосудов на системное введение L-аргинина в качестве способа оценки эндотелиальной функции сосудов головного мозга. Как и в наблюдениях D.C. Reutens et al. [17], в нашем исследовании инфузия L-аргинина привела к повышению концентрации цитруллина в плазме крови пациентов, подтверждая гипотезу о том, что L-аргинин оказывает стимулирующее действие на систему NO. D. Tousoulis et al. [15] установили, что при тяжелом атеросклеротическим стенозе коронарных артерий и осложненных атеросклеротических бляшках местная L-аргининопосредованная реактивность сосудов повышена. Полученные нами данные по реактивности сосудов головного мозга, опосредованной L-аргинином, свидетельствуют о том, что у пациентов, которые перенесли цереброваскулярное событие в прошлом, реактивность сосудов в ответ на введение L-аргинина также статистически значимо увеличена, тогда как у пациентов только с СС факторами риска, но без инсульта или ТИА в анамнезе, она не отличается от таковой у здоровых лиц.
Существует несколько, хотя и гипотетических объяснений для этого наблюдения. Не исключено, что предшествующий инсульт или ТИА сами по себе ответственны за повышение реактивности сосудов в ответ на введение L-аргинина. Однако у пациентов данные цереброваскулярные события произошли за несколько недель до включения в исследование. Также не отмечено различий в степени L-аргининопосредованной вазодилатации в зависимости от стороны расположения сосудов. Другим возможным объяснением может быть то, что у пациентов с предшествующим инсультом/ТИА наблюдается локальное уменьшение количества NO, обусловливая их предрасположенность к цереброваскулярным событиям вследствие повышения сосудистого тонуса и снижения кровотока в сосудах головного мозга. Применение экзогенного L-аргинина может способствовать преодолению дефицита NO в сосудах головного мозга и обеспечению более высокой степени вазодилатации. H. Drexler et al. [11] обнаружили, что применение L-аргинина приводит к улучшению коронарной микроциркуляции у пациентов с гиперхолестеролемией. Другие исследователи также отметили улучшение потокопосредованной дилатации периферических артерий после введения L-аргинина [13].
У пациентов, перенесших инсульт/ТИА, также отмечали статистически значимо более высокие значения ТКИМ общих сонных артерий, что является известным суррогатным маркером риска развития ИМ или инсульта [7, 8]. Однако между ТКИМ и L-аргининопосредованной реактивностью сосудов корреляция не установлена. Результаты регрессионного анализа подтвердили широко известный факт о связи высоких значений ТКИМ, равно как и высоких уровней ХС, и повышенного риска развития инсульта, в то же время реакция сосудов на введение L-аргинина не зависела от уровня ХС и ассоциировалась только с наличием в анамнезе инсульта/ТИА и уровнями фибриногена. Таким образом, мы предполагаем, что ТКИМ указывает на другой вид риска, отличный от ассоциированного с реакцией сосудов на L-аргинин. Одна из гипотез состоит в том, что ТКИМ связана с ранними структурными изменениями преимущественно в крупных артериях (макроангиопатия), тогда как эффект L-аргинина отражает функциональные изменения микроциркуляции головного мозга. Оцениваемые с помощью транскраниальной допплерографии изменения скорости кровотока в СМА представляются связанными, главным образом, с изменением диаметра расположенных дистальнее мелких сосудов сопротивления (и, следовательно, с церебральным кровотоком), а не с изменениями диаметра самой СМА [25]. В исследовании с периодом последующего наблюдения, которое проводится в настоящее время, пытаются установить, может ли риск микроангиопатического инсульта или ТИА быть предсказан на 5-летний период на основании повышенной реактивности сосудов в ответ на введение L-аргинина.
Пока еще слишком рано выдвигать гипотезу о том, что повышенная реактивность сосудов в ответ на введение L-аргинина ассоциируется с повышенным риском развития инсульта в будущем. Однако в данном исследовании было установлено, что наличие инсульта/ТИА в анамнезе ассоциируется с повышенной L-аргининопосредованной реактивностью сосудов. Проводимое в настоящее время исследование даст возможность установить, меняется ли реактивность сосудов с течением времени, а также, в частности, если ли изменения в частоте цереброваскулярных событий у пациентов с повышенной реактивностью сосудов, опосредованной L-аргинином. Данные продолжительных наблюдений могут подтвердить применимость L-аргинина в качестве маркера риска развития инсульта в случае, если будет установлена связь между накоплением цереброваскулярных событий и повышенной реактивностью сосудов у пациентов.
Уведомления
Данное исследование получило поддержку в виде гранта от Bundesministerium für Bildung und Forschung «Kompetenznetz Schlaganfall», Проект А6. Мы также хотим выразить нашу особую признательность персоналу лаборатории Dr. Endress (Charité, Berlin) и Dr. Wanner (Harlaching, Munich) за выполнение лабораторных анализов и Jacqueline Schneider за техническую поддержку.
Список литературы находится в редакции
Материалы напечатаны в Therapia № 2 (77) 2013
Кардіопротекторний ефект донатора оксиду азоту в пацієнтів з артеріальною гіпертензією
Резюме: Останнє десятиліття ознаменувалося інтенсивним розвитком фундаментальних та клінічних досліджень щодо ролі судинного ендотелію в ґенезі серцево-судинних захворювань (ССЗ). Сьогодні увага дослідників прикута до вивчення ролі дисфункції ендотелію (ДЕ) в патогенезі ССЗ, а також до пошуку способів її ефективної корекції. В статті наводяться дані міжнародних і українських публікацій щодо можливого кардіопротекторного ефекту донатора оксиду азоту […]
ЗДОРОВ’Я НЕФРОНА — ЗАПОРУКА СТАБІЛЬНОГО АРТЕРІАЛЬНОГО ТИСКУ
Хронічна хвороба нирок (ХХН) є однією з найбільш поширених проблем у системі охорони здоров’я з тяжкими соціальними й економічними наслідками. Ця гетерогенна група захворювань об’єднує будь-які порушення нормальної структури й функції нирок з подальшим виникненням ниркових і позаниркових розладів, що мають несприятливий вплив на більшість систем організму. Важливою проблемою в усьому світі на сьогодні є […]
