ОРГАНОПРОТЕКТОРНІ МОЖЛИВОСТІ L-АРГІНІНУ В ЛІКУВАННІ ПАЦІЄНТІВ З АРТЕРІАЛЬНОЮ ГІПЕРТЕНЗІЄЮ
ОРГАНОПРОТЕКТОРНІ МОЖЛИВОСТІ L-АРГІНІНУ В ЛІКУВАННІ ПАЦІЄНТІВ З АРТЕРІАЛЬНОЮ ГІПЕРТЕНЗІЄЮ
Незважаючи на досягнутий значний прогрес у діагностиці та лікуванні артеріальної гіпертензії (АГ) остання залишається одним з головних чинників інвалідизації та смертності не тільки в Україні, але й в усьому світі [1]. Пов’язане це насамперед з зумовленим АГ ураженням органів – мішеней: головного мозку, серця та нирок.
Згідно з рекомендаціями Європейського товариства гіпертензії (ЄТГ) та Європейського товариства кардіологів (ЄТК) 2018 р. ураження органів, викликане гіпертензією, визначається як структурні або функціональні зміни артерій або органів, які вони кровопостачають (серця, судин, головного мозку, очей та нирок), що обумовлені підвищеним артеріальним тиском (АТ) [2]. Ураження органів, обумовлене АГ, частіше зустрічається при важкій або тривало існуючій АГ, однак може виявлятися і при менш важкому перебігу захворювання, збільшуючи серцево-судинний ризик, при цьому за ураження декількох органів ризик зростає більшою мірою [3-5]. З іншого боку, зниження АТ на тлі антигіпертензивної терапії дозволяє досягти регресу або уповільнити прогресування ураження органів-мішеней, знизити ризик розвитку серцево-судинних захворювань (ССЗ), покращуючи прогноз пацієнта [6-8].
Запобігти виникненню та розвитку ураження органів-мішеней може раннє їх виявлення та призначення ефективної антигіпертензивної терапії, при чому інтенсивність антигіпертензивної терапії пов’язана не тільки з наявністю ураження органів-мішеней, але й додаткових факторів серцево-судинного ризику (цукрового діабету, ожиріння, паління) [9]. Крім того, накопичено докази про позитивні наслідки більш жорсткого контролю АТ (САТ < 130 проти САТ 130-139 мм рт.ст.) щодо зниження ризику ССЗ та смерті від них, принаймні в пацієнтів молодше 65 р. [10].
Окрім ступеня зниження АТ важливим фактором органопротекції при АГ є швидкість його зниження. Так в останніх Рекомендаціях ЄТГ/ЄТК вказано, що 3 міс. є оптимальним строком для досягнення цільового АТ у пацієнтів з АГ [2].
Ще однією важливою умовою ефективного захисту органів-мішеней при АГ є використання препаратів з доведеною органопротекторною дією до яких відносять антигіпертензивні препарати першої лінії: інгібітори ангіотензин перетворюючого ферменту (іАПФ), блокатори рецепторів ангіотензину ІІ (БРА), блокатори кальцієвих каналів (БКК), тіазидоподібні/тіазидні діуретики, бета-адреноблокатори. При цьому згідно Рекомендаціям ЄТГ/ЄТК (2018 р) ініціація антигіпертензивної терапії має ґрунтуватися на подвійній комбінації у складі блокатора РААС (іАПФ або БРА) і БКК або тіазидного/тіазидоподібного діуретика, що вважається оптимальною терапією для всіх проявів ураження органів, пов’язаних з АГ, не виділяючи переваги певного класу антигіпертензивних препаратів у органопротекції [2].
Проте, зважаючи на високий ризик серцево-судинних ускладнень АГ, триває пошук додаткових шляхів захисту органів-мішеней. Відомо, що одним із провідних патофізіологічних механізмів розвитку ураження органів-мішеней при АГ є дисфункція ендотелію та зниження біодоступності оксиду азоту (NO) [11, 12]. Дослідження демонструють, що втрата ендотеліального гомеостазу при АГ відіграє ключову роль у формуванні міокардіальних, церебральних та ниркових ускладнень. У дослідженні G. Modena та співавт., які досліджували потік залежну дилатацію плечової артерії у 400 жінок у постменопаузальний період з легкою та помірною АГ показано, що відновлення ендотеліального гомеостазу може бути важливим фактором серцево-судинного захисту [13]. У цьому проспективному дослідженні продемонстровано, що неможливість покращити функцію ендотелію протягом 6-тимісячного періоду фармакологічної терапії передбачало гірший серцево-судинний результат, незалежно від методу лікування або величини зниження АТ. В цілому це дозволяє припустити, що усунення дисфункції ендотелію може бути важливою терапевтичною мішенню при захворюваннях, спричинених АГ.
Оскільки втрата біодоступності оксиду азоту є основною особливістю ендотеліальної дисфункції при АГ, введення додаткового субстрату для посилення продукції NO може дати додаткові переваги в органопротекції при АГ.
Амінокислота L-аргінін є основним субстратом для синтезу судинного оксиду азоту. Численні дослідження, хоча і різною мірою, демонструють сприятливий вплив L-аргініну на продукцію оксиду азоту та функцію ендотелію як при короткостроковому, так і тривалому застосуванні. В ряді клінічних досліджень введення L-аргініну покращувало ендотелійзалежну вазодилатацію при гіперхолестеринемії та атеросклерозі [14,15].
Метою дослідження було вивчення впливу препарату L-аргініну (препарат Тівортін, виробництва ТОВ «Юрія-Фарм») на показники церебральної гемодинаміки та структурно-функціонального стану нирок задля з’ясування можливостей додаткового органопротекторного впливу у пацієнтів з АГ.
Матеріал та методи дослідження
В дослідження було включено 60 пацієнтів з неконтрольованою АГ, середній вік 59,6±1,6 років (чоловіків 18,5%, жінок 81,5%).
Критеріями включення в дослідження були:
- неконтрольована АГ І-ІІ стадії, 1-3 ступеню;
- вік від 18 до 80 років;
- згода пацієнта на участь в дослідженні.
В дослідження не включали пацієнтів за умов: відомої підвищеної чутливості до препарату L-аргінін або його компонентів; наявність вторинної АГ; міокардит, вади серця, тяжка серцева недостатність; цукровий діабет в фазі декомпенсації та/або з епізодами гіпоглікемії в анамнезі; інфекційні захворювання; вагітність та грудне вигодування; печінкова і ниркова недостатність; злоякісні новоутворення; супутня терапія з використанням лікарських засобів з подібними досліджуваному препарату фармакологічними ефектами або механізмом дії.
На етапі скринінгу всім пацієнтам були проведені реєстрація скарг, збір анамнезу, загальноклінічне обстеження, яке включало вимірювання офісного АТ та добове моніторування артеріального тиску (ДМАТ) за загальноприйнятими методиками, фізикальне та неврологічне обстеження, біохімічне дослідження крові та визначення альбумінурії у добовій сечі.
Стан церебрального кровоплину оцінювали за допомогою дуплексного сканування екстра- та інтракраніальних артерій, яке проводили на апараті “Sonoline Omnia” (“Siemens”, Німеччина) по стандартній методиці на початку та в кінці дослідження [16].
Визначали діаметри загальної (ЗСА), внутрішньої (ВСА) та зовнішньої (ЗоСА) сонних артерій та товщину комплексу інтима-медія (ТКІМ) в області біфуркації ЗСА та бляшки, а також показники кровоплину по ЗСА, ВСА, ЗоСА, середньої (СМА), передньої (ПМА), задньої (ЗМА) мозкових та основної (ОА) артерій, які включали максимальну систолічну (ЛСШК), мінімальну діастолічну (ЛДШК) швидкості кровоплину, а також розраховували їх індекс резистивності (ІР).
Для оцінки стану цереброваскулярної реактивності виконували тест з затримкою дихання, при цьому використовували усереднену по часу максимальну швидкість кровоплину в середній мозковій артерії з двох сторін та обчислювали середній з двох сторін показник до та після проведення проби, з подальшим розрахунком індексу реактивності.
Всім пацієнтам проведена допплерографія ниркових артерій з вимірюванням швидкісних параметрів кровотоку та розрахунком ниркового індексу резистивності (НІР). Допплерівський сигнал отримували від міждольових артерій з верхньої, середньої та нижньої третини обох нирок і розраховували середнє значення з шести вимірювань (по три виміри з кожної нирки).
Для оцінки ендотеліального механізму регуляції судинного тонусу використовували пробу з компресією плечової артерії, яку проводили за загальноприйнятою методикою, дотримуючись всіх необхідних умов її проведення [17].
Всі пацієнти, включені в дослідження, отримували лікування відповідно до протоколу надання допомоги пацієнтам з АГ, затвердженого наказом МОЗ України №384 від 24.05.2012 року, яке включало антигіпертензивну терапію, статини, антитромбоцитарні та цукрознижуючі препарати за наявності показань.
Пацієнти методом сліпих конвертів були розподілені на дві групи: основну – 30 пацієнтів (з них 83,3 % жінки) та контрольну – 30 пацієнтів (77,8% жінки). Додатково до стандартної терапії АГ пацієнтам основної групи був призначений аргініну гідрохлорид (препарат Тівортін (розчин для інфузій) виробництва ТОВ «Юрія-Фарм») по 42 мг/мл 100 мл: довенно крапельно (повільно) по 100 мл 1 раз на добу – 10 днів з подальшим застосуванням внутрішньо під час їжі L-аргініну аспартат (препарат Тівортін Аспартат розчин оральний 200 мг/мл флакон 200 мл виробництва ТОВ «Юрія-Фарм») по 10 мл (2 мірні ложки) 2 рази на добу впродовж 20 днів.
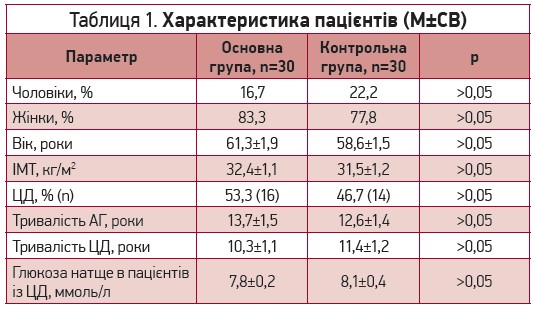
Пацієнти основної групи та групи контролю були співставні за віком, статтю, рівнем АТ та тривалістю АГ, індексом маси тіла (ІМТ), частотою ЦД та рівнем глікемії (табл.1).
Таблиця 1. Характеристика пацієнтів (М±СВ)
Всі пацієнти приймали антигіпертензивну терапію яка включала: 4 препарати (43% пацієнтів), 3 препарати (37% пацієнтів) та 2 препарати (20% пацієнтів). В основній і в контрольній групах розподіл частоти кількості застосованих препаратів був зіставним. В основній та контрольній групах більшість пацієнтів приймали статини (в основній групі -82,1% пацієнтів, в контрольній – 81,5% пацієнтів).
Отримані дані обробляли за допомогою методів варіаційної статистики з використанням програми SPSS 10.0. Для кількісних змінних висновки про наявність неоднорідності зроблені на основі порівняння за допомогою критерія Стюдента (з поправкою Уелча) для нормально розподілених даних або критерія Манна-Уітні, якщо дані хоча б в одній групі не підлягали нормальному розподілу. Кількісні показники наведені у вигляді середньої величини (М) з відповідним стандартним відхиленням від середньої величини (СВ).
Результати та їх обговорення.
Пацієнти обох груп мали зіставний вихідний рівень офісного АТ (табл. 2). Аналіз динаміки показників САТ і ДАТ показав вірогідне зниження АТ в кінці періоду спостереження в обох групах, що свідчить про ефективність підібраної антигіпертензивної терапії, при цьому величина зниження АТ була зіставною між групами: зниження середньодобового САТ становило 13,1 % у основній групі та 11,4 % у контрольній групі (р=0,18), середньодобового ДАТ відповідно 10,8 % та 12,8 % (р=0,08). Такі самі тенденції спостерігались і для ступеню зниження САТ і ДАТ в денний та нічний періоди доби. Вірогідних змін частоти серцевих скорочень за період спостереження не відбулось (табл.2).
Таблиця 2. Показники АТ у пацієнтів основної та контрольної груп до та після лікування (М±СВ)
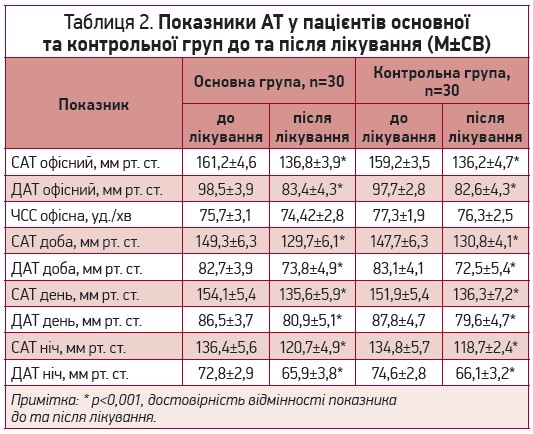
* – р<0,001 вірогідність відмінності показника до та після лікування
Відомо, що величина нічного зниження АТ пов’язаний зі ступенем ураження органів–мішеней. У нашому дослідженні величина добового індексу САТ і ДАТ достовірно не змінилась. У основній групі ДІ САТ до лікування становив 11,5±1,8 %, після 10,9±1,7 %, а в групі контролю 11,3±1,8 % та 12,9±1,8 % відповідно.
Отже, в обох групах на фоні проведеної антигіпертензивної терапії спостерігалось вірогідне зіставне зниження показників АТ як офісних, так і середніх за добу, денний та нічний період.
Відомо, що з підвищенням АТ пов’язані структурні зміни як великих, так і мілких судин. На макросудинному рівні це проявляється потовщенням комплексу інтима-медія, збільшенням просвіту судин та жорсткості судинної стінки. На мікрорівні – вазоконстрикцією, еутрофічним ремоделюванням (збільшення співвідношення стінки до просвіту), порушенням здатності до розтягнення, зниженням вазодилататорного резерву. Такі зміни судин призводять до пов’язаних з гіпертензією змін органів мішеней [18]. Головними механізмами регуляції судинного тонусу та забезпечення сталого органного кровоплину, перш за все у таких органах як мозок та нирки, є ендотеліальний, метаболічний та міогенний [11].
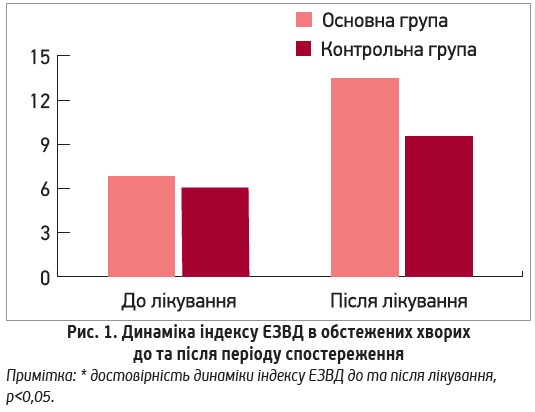
З метою вивчення впливу L-аргініну на функцію ендотелію пацієнтам обох груп до та після лікування було проведено пробу ендотелійзалежної вазодилатації (ЕЗВД). На початку періоду спостереження індекс ЕЗВД в основній групі становив 6,65±0,73 %, що не відрізнялось від показника групи контролю 6,20±0,92% і засвідчувало порушення ендотеліальної функції (в нормі цей показник має бути більше 10%) у обстежених. В кінці періоду спостереження показник ЕЗВД зріс у пацієнтів обох груп, проте під впливом L-аргініну він збільшився у 2 рази і становив 13,59±0,61% (р=0,004), натомість у пацієнтів групи контролю його зростання було достовірним, проте менш виразним – до 9,51±0,89% (р=0,03) (Рис. 1).
Аналіз показників ЕЗВД у пацієнтів з цукровим діабетом виявив, що додавання до антигіпертензивної терапії L-аргініну призводить не тільки до значного покращення функції ендотелію, що проявлося збільшенням індексу ЕЗВД з 5,00±0,5 до 11,3±0,6 % (р=0,02), але й вірогідним збільшенням діаметру плечової артерії з 4,45±0,47 мм до лікування до 4,83±0,41 мм-після (р=0,02).
З метою оцінки структурних параметрів та показників кровоплину пацієнтам з АГ було проведено дуплексне сканування магістральних екстра- та інтракраніальних артерій. За його результатами було виявлено, що 58,8% пацієнтів основної групи та 53,7% пацієнтів контрольної групи мали гемодинамічно незначимі атеросклеротичні бляшки.
В нашому дослідженні за період спостереження не було виявлено вірогідних змін структурно-морфологічних показників сонних артерій (табл. 3). Однак, в основній групі спостерігалась тенденція до збільшення діаметру ЗСА.
Таблиця 3. Структурно-морфологічні показники сонних артерій у обстежених пацієнтів до та в кінці періоду спостереження (М±СВ)
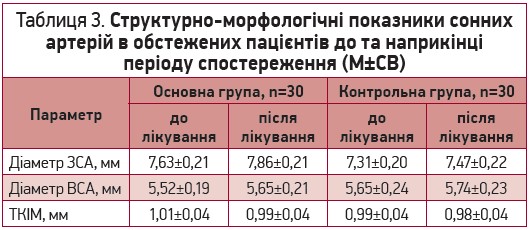
Примітки: ЗСА – загальна сонна артерія; ВСА – внутрішня сонна артерія; ТКІМ – товщина комплексу інтима-медія
Аналіз показників швидкості кровоплину по екстра- та інтракраніальним артеріям в обох групах не виявив їх вірогідних змін в кінці періоду спостереження у порівнянні з такими на початку дослідження.
Таблиця 4. Динаміка показників кровоплину по екстра- та інтракраніальним артеріям у обстежених осіб основної та контрольної групи (М±СВ)
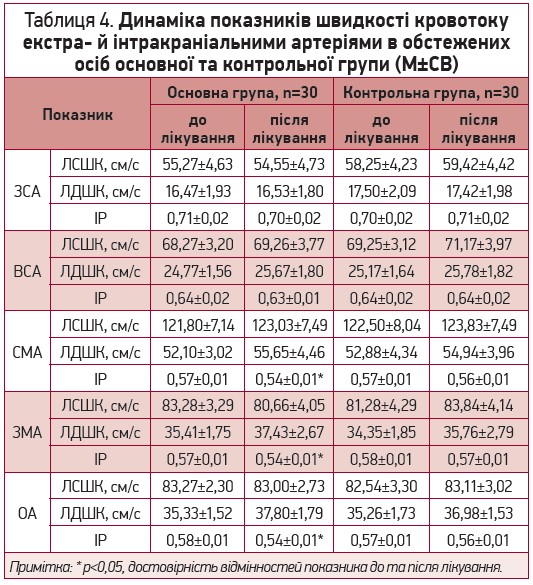
Примітки: * – р<0,05 достовірність відмінностей показника до та після лікування; ЛСШК – лінійна систолічна швидкість кровоплину; ЛДШК – лінійна діастолічна швидкість кровоплину; ІР – індекс резистивності; ЗСА – загальна сонна артерія; ВСА – внутрішня сонна артерія; СМА – середня мозкова артерія; ЗМА – задня мозкова артерія; ОА – основна артерія
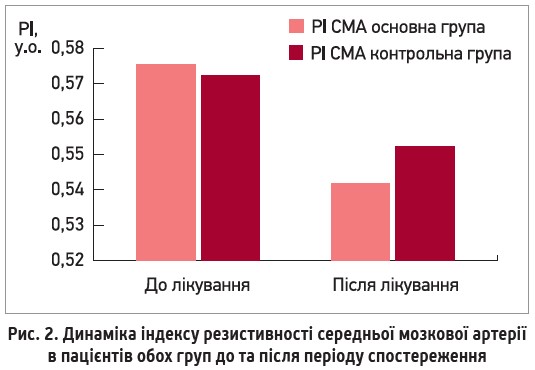
Однак, на тлі додавання до стандартної терапії АГ L-аргініну спостерігалось вірогідне зниження індексів периферичного судинного опору інтракраніальних артерій в основній групі, що свідчить про зменшення судинного опору дистальніше місця локації (рис.2).
З метою дослідження механізмів регуляції мозкового кровоплину була виконана метаболічна вазодилататорна проба з затримкою дихання. Для забезпечення сталого органного кровоплину, перш за все мозкового та ниркового, існує компенсаторна система, яку називають системою ауторегуляції. Відомо, що низькі показники цереброваскулярної реактивності асоціюються з підвищеним ризиком розвитку порушень мозкового кровобігу. [19].
На початку дослідження реакція кровоплину на стимуляцію була негативною у пацієнтів обох груп, а індекс реактивності становив 0,90±0,01 у.о. у основній групі та 0,92±0,01 у.о. – у групі контролю, що свідчить про напруження механізмів регуляції церебрального гомеостазу у пацієнтів з неконтрольованою АГ. Додавання L-аргініну до антигіпертензивної терапії сприяло покращенню реакції кровоплину на вазодилататорну метаболічну пробу у пацієнтів основної групи, що проявлялось вірогідним збільшенням індексу реактивності і свідчить про відновлення резерву вазодилатації артеріол на гіперкапнію. Так, індекс реактивності в основній групі збільшився майже на третину (29%) до 1,16±0,01 у.о. (р=0,02), натомість в контрольній – лише на 13 % до 1,04±0,01 у.о. (р=0,03), а реакція стала позитивною найбільш імовірно за рахунок відновлення здатності артеріол до вазодилатації.
Отже, додавання L-аргініну до стандартної терапії АГ сприяло зниженню судинного тонусу, відновленню вазодилататорних механізмів ауторегуляції мозкового кровоплину, покращенню функціонування церебрального ендотелію.
З метою оцінки динаміки функціонального стану нирок було досліджено динаміку ШКФ, альбумінурії та індексу резистивності ниркових артерій на етапах дослідження. Було проведено дослідження показників ниркового кровотоку до та після додавання L-аргініну до стандартної терапії АГ. Аналіз динаміки ШКФ показав, що в групі L-аргініну на тлі зниження АТ відбулось незначне, проте вірогідне зростання ШКФ, тоді як в групі порівняння ШКФ залишалась практично незмінною (табл. 5). Аналіз у пацієнтів з ЦД виявив іще більш значну різницю між групами: приріст ШКФ під впливом L-аргініну становив 4,1 мл/хв/1,73 м2 (з 68,8±2,9 до 72,9±2,3 мл/хв/1,73 м2; р=0,03), а в групі порівняння – навпаки спостерігали незначне зниження ШКФ з 71,2±3,2 до 67,7±3,7 мл/хв/1,73 м2. У пацієнтів з ЦД також більш значною була динаміка альбумінурії, яка зменшилась в групі втручання на 32,0 % (з 34,7 до 23,6 мг/дл; р=0,02), натомість в групі порівняння на 24,4% (38,3 до 28,4 мг/дл; р=0,02).
Альбумінурія з одного боку є ознакою ураження нирок, а з іншого – непрямим маркером ендотеліальної дисфункції. В нашому дослідженні паралельно з регресом альбумінурії спостерігали зростання індексу ЕЗВД, що підтверджує позитивний вплив L-аргініну на ендотеліальну функцію та на функцію нирок, зокрема. Регрес альбумінурії є важливим фактором, асоційованим із зменшенням серцево-судинних подій у пацієнтів з АГ [20]. В нашому дослідженні в кінці періоду спостереження у пацієнтів з АГ спостерігалось вірогідне зменшення показника добової альбумінурії, більш значне під впливом L-аргініну. Більш виражена позитивна динаміка функції нирок в групі втручання супроводжувалась зниженням індексу резистивності ниркових артерій з 0,68±0,1 до 0,64±0,1 у.о. (р=0,04), в той же час в групі стандартної терапії НІР залишився незмінним (табл. 5).
Таблиця 5. Динаміка показників функції нирок у пацієнтів основної та контрольної груп впродовж періоду спостереження
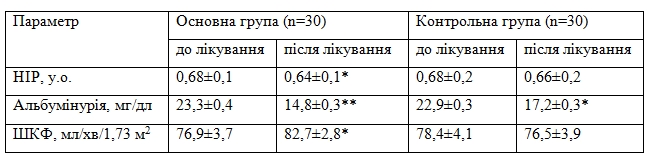
За даними літератури індекс резистивності ниркових артерій асоціюється з гіршим прогнозом та корелює з артеріолосклерозом. Судини нирок є однією з основних мішеней АГ і дуже чутливі до змін функції ендотелію. В роботі, проведеній Yukihito Higashi та співавторів було показано, що зміни функції ендотелію нирок можуть бути причиною, а не наслідком гіпертензії [21].Примітки: НІР – нирковий індекс резистивності, * – р<0,05; ** – р<0,02 достовірність відмінностей показника до та після лікування.
Таким чином, нефропротекторний ефект L-аргініну у нашому дослідженні проявлявся відсутністю зниження ШКФ на тлі зниження АТ, регресом альбумінурії та зменшенням НІР, що свідчить про можливе покращення ниркової мікроциркуляції.
За даними літератури L-аргінін збільшує швидкість кровоплину по церебральним артеріям, у зв’язку з чим деякі автори пропонують використовувати гострий тест з введенням L-аргініну для оцінки функції церебрального ендотелію [22]. У нашому дослідженні ми не виявили вірогідного збільшення швидкості кровоплину по таким магістральним інтракраніальним артеріям як середня, передня, задня мозкові та основна артерії. Це пов’язане насамперед з тим, що ми оцінювали тривалий, впродовж 30 днів, вплив L-аргініну на параметри кровоплину, не вдаючись до гострого тесту. Zimmerman С. та співавтори спостерігали збільшення середньої швидкості кровоплину по середній мозковій артерії, визначеній методом транскраніальної допплерографії, на фоні інфузії L-аргініну у здорових добровольців на 22 % і це середнє збільшення швидкості потоку підтримувалося протягом 30 хвилин інфузії L-аргініну [23]. Наші дані свідчать про те, що застосування L-аргініну впродовж 30 днів чинить позитивний вплив на параметри мозкового кровоплину. Це проявлялось зниженням індексів периферичного судинного опору внаслідок зменшення судинного тонусу дистальніше місця локації та покращення кровоплину.
У нашому дослідженні ми не виявили додаткового впливу додавання L-аргініну на рівень АТ, що може бути пов’язане з оптимальною антигіпертензивною терапією та зниженням АТ до цільових рівнів. У нечисельних дослідженнях вивчався вплив L-аргініну на рівень АТ при АГ і їх результати неоднозначні. В одних показано, що добавка L-аргініну знижує систолічний АТ в межах 2,2 – 5,4 мм рт ст та діастолічний АТ – в межах 2,7 – 3,1 мм рт ст. у пацієнтів з АГ, що супроводжується покращенням ендотелій залежної вазодилатації [24]. В інших – зростання потікзалежної вазодилатації плечової артерії у пацієнтів з АГ не було пов’язане зі зниженням АТ. У пацієнтів зі щойно діагностованою легкою та помірною гіпертензією, додавання L-аргініну знижувало АТ на 8% та зменшувало реноваскулярну резистивність [25]. З іншого боку L-аргінін не сприяв зниженню АТ у пацієнтів зі злоякісною гіпертензією. Можливо тривалість АГ, її тяжкість та ступінь ендотеліальної дисфункції можуть бути важливими факторами відповіді на L-аргінін [26]. Проте гемодинамічні ефекти показані у осіб з нормальним АТ, у яких виявлено дозозалежне зниження АТ під впливом L-аргініну.
Резюме:
Мета дослідження. Вивчення впливу препарату L-аргініну (препарат Тівортін, виробництва ТОВ «Юрія-Фарм») на показники церебральної гемодинаміки та структурно-функціонального стану нирок задля з’ясування можливостей додаткового органопротекторного впливу у пацієнтів з АГ.
Матеріали та методи. В дослідження було включено 60 пацієнтів з неконтрольованою АГ, середній вік 59,6±1,6 років. Пацієнти були розподілені на дві групи: основну та контрольну. Додатково до стандартної терапії АГ пацієнтам основної групи був призначений аргініну гідрохлорид (препарат Тівортін (розчин для інфузій) виробництва ТОВ «Юрія-Фарм») довенно крапельно 10 днів з подальшим застосуванням внутрішньо під час їжі L-аргініну аспартат (препарат Тівортін Аспартат розчин оральний виробництва ТОВ «Юрія-Фарм») впродовж 20 днів.
Результати. З метою вивчення впливу L-аргініну на функцію ендотелію пацієнтам обох груп до та після лікування було проведено пробу ендотелійзалежної вазодилатації (ЕЗВД). Аналіз показників ЕЗВД у пацієнтів з цукровим діабетом виявив, що додавання до антигіпертензивної терапії L-аргініну призводить до збільшення індексу ЕЗВД з 5,00±0,5 до 11,3±0,6 % (р=0,02). Індекс реактивності ниркових артерій в основній групі збільшився майже на третину (29%) до 1,16±0,01 у.о. (р=0,02). Додавання L-аргініну до стандартної терапії АГ сприяло зниженню судинного тонусу, відновленню вазодилататорних механізмів ауторегуляції мозкового кровоплину, покращенню функціонування церебрального ендотелію. Аналіз динаміки ШКФ показав, що в групі L-аргініну на тлі зниження АТ відбулось незначне, проте вірогідне зростання ШКФ, тоді як в групі порівняння ШКФ залишалась практично незмінною. Аналіз у пацієнтів з ЦД виявив іще більш значну різницю між групами: приріст ШКФ під впливом L-аргініну становив 4,1 мл/хв/1,73 м2 (з 68,8±2,9 до 72,9±2,3 мл/хв/1,73 м2; р=0,03), а в групі порівняння – навпаки спостерігали незначне зниження ШКФ з 71,2±3,2 до 67,7±3,7 мл/хв/1,73 м2. У пацієнтів з ЦД також більш значною була динаміка альбумінурії, яка зменшилась в групі втручання на 32,0 % (з 34,7 до 23,6 мг/дл; р=0,02), натомість в групі порівняння на 24,4% (38,3 до 28,4 мг/дл; р=0,02).
Висновки. Додавання L-аргініну пацієнтам з АГ на етапі підбору антигіпертензивної терапії сприяє покращенню функції ендотелію, мозкового та ниркового кровоплину, відновленню цереброваскулярної реактивності, зменшенням судинного тонусу та мікроальбумінурії. У пацієнтів із супутнім ЦД додавання L-аргініну на етапі підбору антигіпертензивної терапії на тлі покращання функції ендотелію сприяє зменшенню індексу резистивності ниркових артерій, регресу мікроальбумінурії та зростанню ШКФ.
Ключові слова:
артеріальна гіпертензія, L-аргінін, органопротекція.
Автори:
Л. А. Міщенко, д.м.н., О. В. Гулкевич, к.м.н., Б. В. Деркач, ДУ «ННЦ «Інститут кардіології ім. М. Д. Стражеска» НАМН України», м. Київ
ВИСНОВКИ:
- Пацієнтам з неконтрольованою АГ притаманні ознаки гіпертензивної макро- та мікроангіопатії у вигляді зміни геометрії сонних артерій, їх атеросклеротичного ураження та підвищення судинного опору.
- Ураження органів-мішеней у пацієнтів з неконтрольованою АГ проявляється порушенням ендотеліальної функції, цереброваскулярної реактивності, підвищенням судинного тонусу та мікроальбумінурією.
- Додавання L-аргініну пацієнтам з АГ на етапі підбору антигіпертензивної терапії сприяє покращенню функції ендотелію, мозкового та ниркового кровоплину, відновленню цереброваскулярної реактивності, зменшенням судинного тонусу та мікроальбумінурії.
- У пацієнтів із супутнім ЦД додавання L-аргініну на етапі підбору антигіпертензивної терапії на тлі покращання функції ендотелію сприяє зменшенню індексу резистивності ниркових артерій, регресу мікроальбумінурії та зростанню ШКФ.
ЛІТЕРАТУРА
- Forouzanfar MH, Liu P, Roth GA et al. Global burden of hypertension and systolic blood pressure of at least 110 to 115 mm Hg, 1990-2015. JAMA 2017 –317 –p.165 – 182.
- Williams B., Mancia G. et al. 2018 ESC/ESH Guidelines for the management of arterial The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. Journal of Hypertension: 2018 – Vol. 36 – Issue 10 – p 1953–2041.
- Perrone-Filardi P, Coca A, Galderisi M. et al. Noninvasive cardiovascular imaging for evaluating subclinical target organ damage in hypertensive patients: a consensus article from the European Association of Cardiovascular Imaging, the European Society of Cardiology Council on Hypertension and the European Society of Hypertension. J Hypertens 2017; Vol. 35 p.1727–1741.
- Greve SV, Blicher MK, Sehestedt T. et al. Effective risk stratification in patients with moderate cardiovascular risk using albuminuria and atherosclerotic plaques in the carotid arteries. J Hypertens 2015 Vol. 33 p.1563–1570.
- Volpe M, Battistoni A, Tocci G. et al. Cardiovascular risk assessment beyond systemic coronary risk estimation: a role for organ damage markers. J Hypertens 2012 Vol. 30 p. 1056–1064.
- Chowdhury EK, Langham RG, Ademi Z. et al. Rate of change in renal function and mortality in elderly treated hypertensive patients. Clin J Am Soc Nephrol 2015 Vol. 10 p. 1154–1161.
- Bang CN, Devereux RB, Okin PM. Regression of electrocardiographic left ventricular hypertrophy or strain is associated with lower incidence of cardiovascular morbidity and mortality in hypertensive patients independent of blood pressure reduction – A LIFE review. J Electrocardiol 2014 Vol. 47 p. 630–635.
- Ettehad D., Emdin C.A , Kiran A. et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet. 2016 Vol. 387(10022) p.957-967. doi: 10.1016/S0140-6736(15)01225-8.
- Banegas JR, Lopez-Garcia E, Dallongeville J. et al. Achievement of treatment goals for primary prevention of cardiovascular disease in clinical practice across Europe: the EURIKA study. Eur Heart J 2011 Vol. 32 p. 2143–2152.
- Thomopoulos C., Parati G., Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension: 7. Effects of more vs. less intensive blood pressure lowering and different achieved blood pressure levels – updated overview and meta-analysesof randomized trials. J Hypertens. 2016. Vol 34(4). P. 613-622. doi10.1097/HJH.0000000000000881.
- 11. Peterson E.C., Wang Z., Britz G. Regulation of cerebral blood flow. International J of Vascular Medicine. – 2011. article ID 8P. doi: 10.1155/2011/823525.
- Versari D., Daghini E., Virdis A. et al. Endothelial dysfunction as a target for prevention of cardiovascular disease. Diabetes Care.2009 Vol. 32 (Suppl 2) p. 314-321.doi: 10.2337/dc09-S330.
- 13. Modena M. G., Bonetti L., Coppi F. et al. Prognostic role of reversible endothelial dysfunction in hypertensive postmenopausal women. J. Am. Coll. Cardiol 2002 Vol. 40 p.505–510.
- Quyyumi A. A., Dakak N., Diodati J. G. et al. Effect of l-arginine on human coronary endothelium-dependent and physiologic vasodilation. J. Am. Coll. Cardiol. 1997 Vol. 30 p. 1220 – 1227.
- Lerman A., Burnett J.C.J., Higano S. T.et al. Long-term l-arginine supplementation improves small-vessel coronary endothelial function in humans. Circulation 1998 Vol. 97 p. 2123–2128.
- Valdueza J.M., Schreiber S.J., Roehl J.-E., Klingebiel R. Neurosonology and Neuroimaging of stroke. Thieme Second edition. 2016. 768 P.
- 1 Corretti MC, Anderson TJ, Benjamin EJ et al. Guidelines for the ultrasound assessment of endothelial-dependent flow-mediated vasodilatation of the brachial artery. J Am Coll Cardiol 2002 Vol.39 p. 257-265.
- Rizzoni D., Agabiti-Rosei E. Structural abnormalities of small resistance arteries in essential hypertension. Intern Emerg Med. – 2012 – Vol.7 p. 205-12. doi: 10.1007/s11739-011-0548-0.
- Vernieri F., Pasqualetti P., Passarelli F. et al. Outcome of carotid artery occlusion is predicted by cerebrovascular reactivity // Stroke, 1999, V.30(3), p. 593-598.
- 20. Ibsen H, Olsen MH, Wachtell K, et al. Reduction in albuminuria translates to reduction in cardiovascular events in hypertensive patients: losartan intervention for endpoint reduction in hypertension study. Hypertension 2005 Vol. 45 p 198-202.
- 21. Higashi Y, Chayama Renal endothelial dysfunction and hypertension. J Diabetes Complications 2002- Vol.16(1) p.103-107.
- 22. Pretnar-Oblak J. Cerebral endothelial function determined by cerebrovascular reactivity to L-Arginine. BioMed Reserch International. 2014, Article SD 601515, 8 p. dx.doi.org/10.1155/2014/ 601515.
- 23. Zimmermann C. , Wimmer M., Haberl R. L. L-arginine-mediated vasoreactivity in patients with a risk of stroke. Cerebrovascular Diseases, 2004. Vol. 17, no. 2-3, p. 128–133.
- 24. Borghi C., Tsioufis K., Agabiti-Rosei E. et al Nutraceuticals and blood pressure control: a European Society of Hypertension position document/ J. Hypertens. 2020.Vol. 38. p.799-812.
- 25. Higashi Y., Oshima T., Ozono R.et al. Effects of L-arginine infusion on renal hemodynamics in patients with mild essential hypertension // Hypertension. Vol. 25 p. 898-902.
- 26. Sato K., Kinoshita M., Kojima M.et al. Failure of L-arginine to induce hypotension in patients with a history of accelerated-malignant hypertension. // J Hum Hypertens. 2000. Vol. 14 p. 485-488.
Кардіопротекторний ефект донатора оксиду азоту в пацієнтів з артеріальною гіпертензією
Резюме: Останнє десятиліття ознаменувалося інтенсивним розвитком фундаментальних та клінічних досліджень щодо ролі судинного ендотелію в ґенезі серцево-судинних захворювань (ССЗ). Сьогодні увага дослідників прикута до вивчення ролі дисфункції ендотелію (ДЕ) в патогенезі ССЗ, а також до пошуку способів її ефективної корекції. В статті наводяться дані міжнародних і українських публікацій щодо можливого кардіопротекторного ефекту донатора оксиду азоту […]
ЗДОРОВ’Я НЕФРОНА — ЗАПОРУКА СТАБІЛЬНОГО АРТЕРІАЛЬНОГО ТИСКУ
Хронічна хвороба нирок (ХХН) є однією з найбільш поширених проблем у системі охорони здоров’я з тяжкими соціальними й економічними наслідками. Ця гетерогенна група захворювань об’єднує будь-які порушення нормальної структури й функції нирок з подальшим виникненням ниркових і позаниркових розладів, що мають несприятливий вплив на більшість систем організму. Важливою проблемою в усьому світі на сьогодні є […]
