Новые подходы к проблемным вопросам лечения генитального эндометриоза
Т.Н. Тутченко к. мед. н.
Новые подходы к проблемным вопросам лечения генитального эндометриоза

Генитальный эндометриоз входит в число ведущих причин снижения качества жизни и нарушения фертильности женского населения. По данным Adamson et al. (2010), около 176 млн женщин (от 6 до 10% женского населения) репродуктивного возраста во всем мире страдают от тех или иных симптомов этого недуга. Эндометриоз является причиной тазовых болей у 50–60% девочек-подростков и женщин различных возрастных групп, а также 50% случаев бесплодия у женщин репродуктивного возраста [1, 2].
Хроническое течение эндометриоза и его высокая потенция к рецидивированию после различных видов лечения определяют актуальность вопросов углубленного изучения патогенеза и совершенствования терапевтических подходов к этому заболеванию [2].
Наиболее сложным контингентом для лечения при данной патологии являются женщины, в число эндометриоз-ассоциированных симптомов у которых входит бесплодие. В этой ситуации основными проблемными сторонами лечения эндометриоза являются:
- недостаточно высокая эффективность как чисто медикаментозной, так и сочетанной с оперативными вмешательствами терапии в отношении длительной профилактики рецидивов;
- антирепродуктивный эффект наиболее эффективных групп препаратов (агонисты гонадотропных рилизинг-гормонов, гормональные контрацептивы, гестагены, антиэстрогены, ингибиторы ароматаз); в то же время прием этих медикаментов не всегда обеспечивает достаточно длительный постэффект, необходимый пациенткам с эндометриозом, заинтересованным в фертильности, для зачатия.
В связи с этим существует актуальная потребность в поиске медикаментозных методов лечения эндометриоза, реализующих свои эффекты через негормональные звенья его патогенеза и оказывающих минимальное подавляющее воздействие на репродуктивный потенциал женщины.
На сегодняшний день хорошо изученными составляющими сложной мультифакториальной природы эндометриоза являются: зависимость пролиферативной активности очагов от сывороточных уровней и экспрессии рецепторов эстрогенов, резистентности к прогестерону; измененная активность иммунных клеток и дисбаланс противо- и провоспалительных цитокинов; связь с факторами окружающей среды, состоятельность антиоксидантной системы [3–7]. Все перечисленные процессы обусловлены полиморфизмом одного или нескольких генов, что частично объясняет широкое разнообразие течения заболевания и неодинаковую эффективность лечения у различных лиц [2, 3, 5, 6].
Несмотря на доброкачественную природу, эндометриоз проявляет выраженную способность к инвазии и распространению, в связи с чем новейшие научные работы направлены на исследование такого явления, как «активность эндометриоидных гетеротопий» [2, 8].
В понятие активности в данном случае вкладывается способность эктопического эндометрия к пролиферации и инвазии, индукции симптомов и рецидивированию. Иными словами, скорость пролиферации и распространения очагов эндометриоза определяет время наступления рецидива, а активность синтеза биологически активных веществ – выраженность симптоматики. Так, в исследовании C.J. Sutton (1994) наблюдение за состоянием пациенток с хроническими тазовыми болями на фоне лапароскопически подтвержденного эндометриоза показало спонтанное разрешение симптомов у 17–29%, прогрессирование – у 24–64%, в то время как у 9–59% выраженность жалоб не менялась в течение 12 мес. [9]. Более того, клинические наблюдения показали, что обширность и количество эндометриодных гетеротопий, на чем основано современное стадирование этого заболевания [10], далеко не всегда коррелируют с выраженностью болевого синдрома, дисменореи и бесплодием, а также эффективностью гормональной и симптоматической терапии [2, 8, 9, 11]. Активность эндометриодных очагов также связана с интенсивностью образования в них биологически активных веществ (эстрогенов, провоспалительных цитокинов, факторов роста и ангиогенеза) и, таким образом, способностью к автономному существованию и формированию патогенетического замкнутого круга.
Согласно данным исследований последних лет, важную роль в имплантации, поддержании активности и «выживаемости» эндометриодных очагов как в миометрии, так и в полости малого таза играет сочетание гипоксии, обусловленной ангиоспазмом, с недостаточностью процессов антиоксидантной защиты, а также в значительной мере зависимые от них процессы ангиогенеза и постнатального васкулогенеза [12–14]. Именно эти патогенетические факторы и являются перспективным объектом терапевтического воздействия и предметом активного изучения [14, 15].
Ангиогенез – это формирование новых микрососудов из уже существующих путем ветвления и инвагинации, васкулогенез – формирование сосудов de novo за счет миграции ангиобластических клеток-предшественников. Постнатальный васкулогенез имеет место при репарации тканей после травм, инфаркте миокарда, опухолевом росте и эндометриозе [12]. В ряде исследований продемонстрирована связь между плотностью сосудов в эндометриодных очагах, экспрессией маркеров ангио- и васкулогенеза и выраженностью симптомов, а также эффективностью терапии нестероидными противовоспалительными препаратами и гестагенами [12, 14, 15]. В этой связи в настоящее время ведутся многочисленные исследования препаратов, воздействующих на ангиогенез. Однако, несмотря на то, что результаты исследований in vitro выглядят многообещающими, применение этой группы медикаментов в клинической практике пока невозможно ввиду недостатка данных о их безопасности [2, 15].
Как было сказано выше, основным триггером ангио- и васкулогенеза при эндометриозе является гипоксия. Наличие сосудистого спазма, обусловленного различными факторами (преобладание провоспалительных цитокинов, симпатического тонуса), зарегистрировано в большинстве исследований, посвященных изучению патогенеза эндометриоза.
Имеются также данные о некоторой эффективности антиагрегантной и вазодилатирующей терапии [2]. Дисбаланс процессов свободнорадикального окисления и механизмов антиоксидантной защиты при эндометриозе продемонстрирован множеством работ, часть из которых даже позиционирует окислительный стресс как маркер активности эндометриоза [7, 13, 16]. В качестве причин окислительного стресса при эндометриозе рассматриваются полиморфизм генов систем детоксикации и антиоксидантной защиты, а также истощение механизмов антиоксидантной защиты вследствие гормонального дисбаланса и активности воспалительных процессов [13, 16].
Учитывая доказанную роль гипоксии и окислительного стресса в развитии и поддержании активности эндометриоза, обоснованно рассматривать в качестве терапевтического направления предшественника оксида азота L-аргинин. Клиническое применение препаратов, содержащих аргинин, затрагивает широкий круг проблем современной теоретической и прикладной науки. Многие аспекты применения этого вещества еще не до конца изучены и зачастую противоречивы, что делает данную тему заслуживающей пристального внимания.
Оксид азота (NO ) играет роль универсального регулятора многих биологических функций, имеющих как протекторный, так и повреждающий характер. Так, являясь важным регулятором сосудистого тонуса, обеспечения иммунных реакций, нейрональной передачи и антиоксидантной защиты, при определенных условиях оксид азота может выступать и в роли свободного радикала, оказывающего выраженный деструктивный эффект [16–18].
Механизм воздействия оксида азота на сосудистое русло заключается в следующем: образовавшись в эндотелии, он связывается трехвалентным железом гема, регулируя определенные транскрипционные факторы, например, индуцируемый гипоксией фактор-1, или быстро диффундирует в кровь. В просвете сосуда NO быстро поглощается эритроцитами, вступая в реакцию с двухвалентным железом гемовой части оксигемоглобина с формированием метгемоглобина и NO3. Диффундируя в клетки гладкой мускулатуры сосудов, прилегающие к эндотелию, NO модулирует активность гемсодержащей гуанилатциклазы. Этот фермент дефосфорилирует гуанозинтрифосфат с образованием циклического гуанозинмонофосфата (цГМФ), который в свою очередь активирует К+‑каналы и ингибирует вход ионов кальция в клетки гладкой мускулатуры путем непосредственного угнетения кальциевых каналов, а также активирует протеинкиназу, фосфорилирущую легкие цепи миозина и белки саркоплазматического ретикулума, способствуя секвестрации ионов кальция в саркоплазматической сети. Итогом этого каскада является расслабление клеток гладкой мускулатуры, регулирующее таким образом диаметр сосуда согласно тканевым нуждам. Аналогичным образом действует NO , освобожденный от донаторов [16–18].
Доказано, что NO ответственен за противовоспалительные эффекты, ингибирование экспрессии молекул клеточной адгезии ICAM‑1 (intercellular adhesion molecule-1) и тканевого фактора VCAM-1 (vascular cell adhesion molecule-1), высвобождение хемокинов, таких как моноцитарный хемотаксический фактор МСР-1 (monocyte chemotactic protein-1), а также блокирование агрегации тромбоцитов и фибринолитический эффект [18, 19].
В развитии и прогрессировании связанных с гипоксией патологий ключевыми моментами являются активность эндотелиальной NO-синтазы (еNOS) и биодоступность субстратов или кофакторов [16, 18, 20, 21]. Локальная доступность L-аргинина в качестве субстрата для еNOS может быть снижена вследствие активности аргиназы, утилизирущей L-аргинин для синтеза мочевины и орнитина и таким образом конкурирующей с NO S за доступность субстрата. Кроме того, аккумуляция при различных патологических состояниях эндогенного ингибитора еNOS – асимметричного диметиларгинина (asymmetric dimethylarginine, ADMA ), также нарушает образование NO . Существуют данные о повышенной секреции ADMA у больных с эндометриозом [18, 22, 23]. Таким образом, нарушение NO -зависимого расслабления артерий может быть обусловлено несколькими механизмами: снижением продукции NO, ускоренной его деградацией и изменением цитоархитектоники сосудов. Наибольшее значение в снижении эндотелий‑зависимой вазодилатации придают внутриклеточному оксидативному стрессу – свободнорадикальное окисление резко снижает продукцию NO эндотелиоцитами [13, 16–18]. Роль усиления оксидативного стресса и снижения биодоступности таких вазодилататоров, как NO, была продемонстрирована в экспериментальных исследованиях сосудистой дисфункции во время беременности [24–26].
Необходимо помнить, что эффекты оксида азота в значительной мере дозозависимы, при определенных условиях переходят из протективных в повреждающие. В условиях дефицита L-аргинина NOS может генерировать супероксиданион и перекись водорода, которые способны оказывать токсическое действие при ишемии. Высокие концентрации NO не реализуют свой эффект через цГМФ, а, напротив, оказывают прямое цитотоксическое и иммуногенное воздействие, связываясь супероксидным радикалом, и образуют пероксинитрит, который индуцирует повреждения ДНК и мутации, ингибирует функцию ферментов. Таким образом, в высоких концентрациях NО является фактором эндогенной интоксикации [16, 17].
Существуют единичные сообщения о повышенной экспрессии еNOS в эндометриоидных гетеротопиях, что может быть объяснено наличием функционально дефектной формы фермента либо вторичным характером упомянутого явления [20–23]. Данная ситуация является примером замкнутого порочного патогенетического круга, для разрыва которого необходимо воздействие на отправную точку его формирования – нарушение эндотелий‑зависимой вазодилатации.
Учитывая обширный опыт применения препарата L-аргинина (Tивортин) в акушерской практике для лечения такой формы эндотелиальной дисфункции, как преэклампсия, продемонстрировавший хороший профиль его безопасности [24–26], в сочетании с убедительным теоретическим обоснованием роли NO в патогенезе эндометриоза, рационально исследовать клиническую эффективность L-аргинина при этом заболевании.
Цель исследования: изучить клиническую эффективность донатора оксида азота (L-аргинина) в лечении эндометриоз-ассоциированных межменструальных тазовых болей и дисменореи.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Для достижения поставленной цели было обследовано 64 женщины раннего и активного репродуктивного возраста (средний возраст 32 ± 5,2 года) с установленным на основании клинической картины, ультразвукового, гистероскопического и патоморфологического исследования биоптатов ткани матки диагнозом «аденомиоз». Основными проявлениями аденомиоза у обследованного контингента были полиморфные межменструальные тазовые боли, дисменорея, обильные и длительные менструации. Длительность тазовых болей и дисменореи обследованных больных составляла от 3 до 6 мес.
Критериями исключения были наличие воспалительных заболеваний органов малого таза в острой, подострой и в стадии неполной ремиссии; перенесенные операции на органах малого таза и брюшной полости, тазовые боли, связанные с урологическими, гастроэнтерологическими и неврологическими заболеваниями, прием гормональных и психотропных препаратов на момент обследования и в течение трех предшествующих месяцев, тяжелые соматические заболевания, беременность.
С помощью таблицы случайных цифр пациентки были рандомизированы на две сопоставимые по возрасту группы: группа I (31 женщина) – стандартная терапия болей, связанных с эндометриозом, – диеногест 2 мг в день непрерывно в течение 3 мес.; группа II (33 женщины) – диеногест 2 мг в день непрерывно в течение 3 мес. в сочетании с донатором оксида азота (препарат Tивортин). Терапия Tивортином проводилась по следующий схеме: в первый месяц лечения пациентки получали 5 внутривенных инфузий 4,2% раствора (100 мл) через день, затем продолжали прием пероральной формы Tивортина аспартата по 3 г (15 мл) в сутки в 3 приема курсами по 14 дней в течение 3 мес.
Эффективность терапии в отношении межменструальных и менструальных тазовых болей оценивали на основании визуальноаналоговой шкалы (ВАШ) до начала лечения, после первого, второго и третьего месяцев лечения, а также через один, два и три месяца после окончания терапии. Дополнительно для качественной характеристики межменструальных эндометриоз-ассоциированных тазовых болей использовали Мак-Гилловский болевой опросник (MP Q).
Для оценки динамики менструальной кровопотери использовали графическую шкалу Janssen до начала лечения, а затем после первого, второго и третьего месяцев по окончании терапии. Длительность менструальных кровотечений, включая дни кровомазания, до и после лечения фиксировалась пациентками в дневниках.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
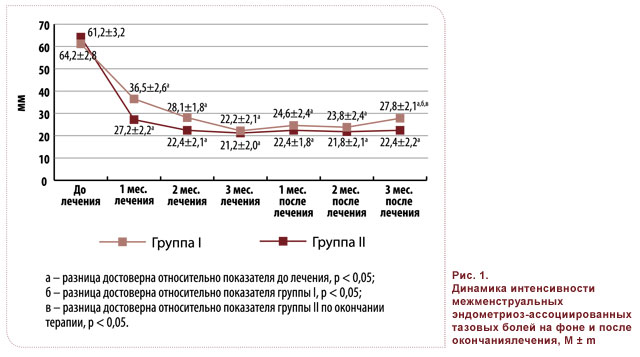
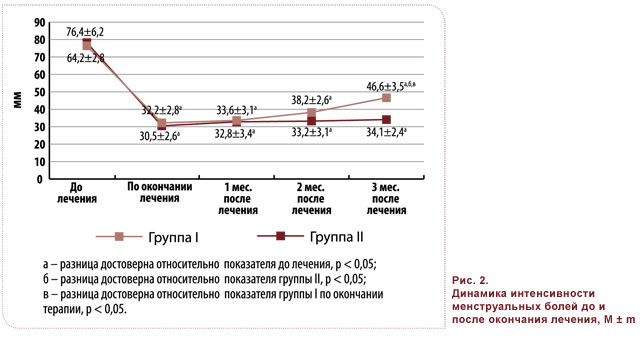
Показатели ВАШ до лечения в группах I и II свидетельствовали о значительной выраженности болевого синдрома как в межменструальный период, так и в период менструаций: 61,2 ± 5,4 и 64,2 ± 4,6 мм; 76,4 ± 6,2 и 78,2 ± 5,5 мм соответственно (рис. 1, 2).
Большое количество избранных дескрипторов боли по Мак-Гилловскому опроснику свидетельствует о присущем эндометриозу полиморфном характере болей, имеющих выраженный вегетативный и эмоциональный компонент и приводящих к астенизации больных (боль: утомляет, изматывает; вызывает чувство: тошноты, тревоги, страха).
Оценка динамики межменструальных эндометриоз-ассоциированных тазовых болей с помощью ВАШ показала их достоверное снижение уже на первом месяце терапии. Однако, несмотря на сопоставимые показатели эффективности в группах I и II в конце третьего месяца лечения (22,2 ± 2,1 и 22,1 ± 2,0 мм соответственно), у пациенток группы II удалось достичь максимального снижения уровня межменструальных тазовых болей уже после второго месяца лечения (рис. 1). Кроме того, в группе II показатели межменструальных тазовых болей по ВАШ в первый и второй месяцы лечения были достоверно ниже по сравнению с показателями группы I (27,2 ± 2,2 против 36,5 ± 2,6 мм и 22,4 ± 2,1 против 28,1 ± 1,8 мм, p < 0,05) (рис. 1). Таким образом, на основании результатов показателей ВАШ на фоне лечения можно констатировать более быстрое достижение снижения интенсивности эндометриоз-ассоциированных межменструальных тазовых болей у пациенток, получавших комбинированную терапию.
Анализ показателей ВАШ после окончания терапии показал более длительное сохранение клинического эффекта в результате комбинированной терапии: в то время как в группе I на третьем месяце после окончания терапии наблюдалось достоверное повышение выраженности болевого синдрома по сравнению с его минимальным показателем на фоне терапии (27,8 ± 2,1 против 22,2 ± 2,1 мм, p < 0,05), в группе II соответствующие показатели не претерпели статистически значимых изменений (21,2 ± 2,0 и 22,4 ± 2,4 мм соответственно) (рис. 1).
Аналогичным образом эффективность терапии в отношении менструальных болей была сопоставимой в группах I и II (показатель ВАШ по окончании лечения 33,6 ± 3,1 и 32,8 ± 3,4 мм соответственно) (рис. 2). Оценка же динамики менструальных болей после окончания терапии продемонстрировала их постепенное возрастание и достоверное усиление к третьему месяцу наблюдения в группе I (с 33,6 до 46,6 мм, p < 0,05), в то время как в группе II соответствующие показатели оставались стабильными и достоверно не отличались от таковых по окончании терапии (32,8 ± 3,4 и 34,1 ± 2,4 мм) (рис. 2).
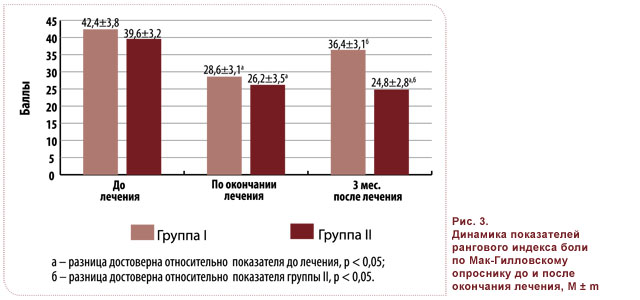
Как видно из рис. 3, достоверное снижение среднего рангового индекса боли по Мак-Гилловскому опроснику по окончании терапии было зарегистрировано в обеих группах исследования (42,4 ± 3,8 и 39,6 ± 3,2 балла). В то же время через три месяца после окончания лечения показатель среднего рангово- го индекса боли в группе I достоверно превышал таковой в группе II (36,4 ± 3,1 против 24,8 ± 2,8, p < 0,05) за счет показателей сенсорной характеристики боли и характеристики силы боли, что подтверждается показателями ВАШ.
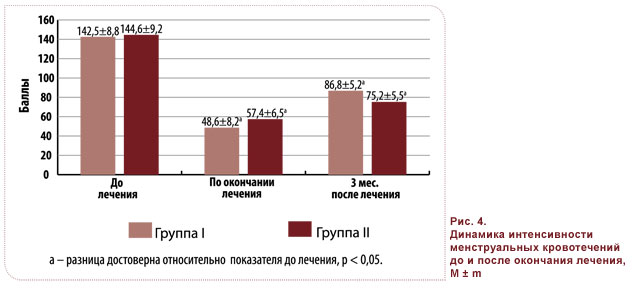
Показатели динамики интенсивности менструальных кровотечений в группах I и II после лечения и на третьем месяце наблюдения не имели достоверных различий и отражали значительное уменьшение кровопотери при обоих терапевтических подходах (рис. 4).
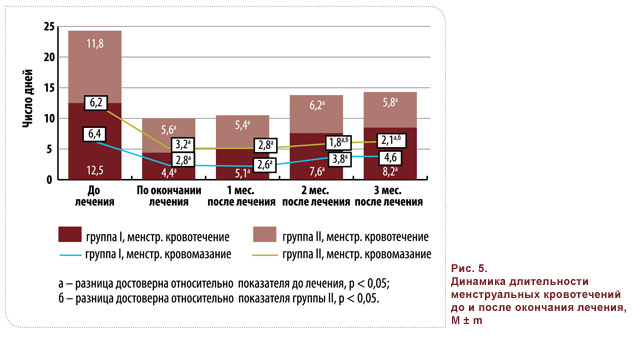
Тем не менее, количество дней менструальных кровотечений и кровомазаний в группе II было значительно меньше во всех циклах периода наблюдения, в основном за счет периодов кровомазания (рис. 5).
Случаев досрочного выбывания пациенток из исследования не было. Переносимость терапии в группах I и II была хорошей: до 20% пациенток обеих групп отмечали незначительную тошноту, эпизодические головные боли. Описанные явления не требовали дополнительной терапии.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ И ВЫВОДЫ
Результаты проведенного исследования продемонстрировали более быстрое достижение клинического эффекта в отношении снижения уровня эндометриоз-ассоциированных симптомов на фоне дополнения базисной терапии (гестаген) негормональным препаратом – донатором оксида азота (L-аргинин). Не менее важным преимуществом терапии, включающей L-аргинин, является стойкость сохранения достигнутого клинического эффекта.
Более выраженный и длительный терапевтический эффект комбинированного подхода к коррекции эндометриоз-ассоциированных симптомов с использованием L-аргинина объясняется его воздействием на эссенциальные патогенетические звенья развития и персистенции эндометриодных гетеротопий – гипоксию и окислительный стресс. Учитывая последние научные данные о роли ангиогенеза в поддержании активности эндометриодных очагов, можно предположить, что именно угнетение этого процесса за счет устранения вазоспазма и гипоксии способствовало достижению пролонгированного терапевтического эффекта при использовании L-аргинина.
Эффективность комбинированной терапии в отношении болевого синдрома, вероятно, обеспечивается несколькими механизмами: нормализацией сосудистого тонуса в органах малого таза, уменьшением окислительного стресса, психостабилизирующим эффектом, а также повышением антибактериальной активности нейтрофилов.
О наличии психостабилизирующего эффекта в данном исследовании свидетельствовала динамика показателей Мак-Гилловского болевого опросника, согласно результатам использования которого у пациенток, получавших L-аргинин, наблюдалось снижение боли не только за счет характеристики силы, но и за счет сенсорной и эмоциональной характеристик.
Учитывая данные литературы о повышенной контаминации половых путей женщин с эндометриозом бактериальной флорой и участии последней в поддержании высоких уровней провоспалительных цитокинов, способность L-аргинина усиливать противомикробную активность нейтрофилов можно определить как одну из составляющих эффективного уменьшения болевого и геморрагического синдрома при эндометриозе [27].
Таким образом, можно заключить, что разноплановые фармакологические эффекты L-аргинина оказывают непосредственное влияние на ряд эссенциальных факторов развития и прогрессирования эндометриоза, что делает применение этого негормонального препарата перспективным в комплексном лечении данного заболевания и, что особенно важно, в профилактике его рецидивов.
Кардіопротекторний ефект донатора оксиду азоту в пацієнтів з артеріальною гіпертензією
Резюме: Останнє десятиліття ознаменувалося інтенсивним розвитком фундаментальних та клінічних досліджень щодо ролі судинного ендотелію в ґенезі серцево-судинних захворювань (ССЗ). Сьогодні увага дослідників прикута до вивчення ролі дисфункції ендотелію (ДЕ) в патогенезі ССЗ, а також до пошуку способів її ефективної корекції. В статті наводяться дані міжнародних і українських публікацій щодо можливого кардіопротекторного ефекту донатора оксиду азоту […]
ЗДОРОВ’Я НЕФРОНА — ЗАПОРУКА СТАБІЛЬНОГО АРТЕРІАЛЬНОГО ТИСКУ
Хронічна хвороба нирок (ХХН) є однією з найбільш поширених проблем у системі охорони здоров’я з тяжкими соціальними й економічними наслідками. Ця гетерогенна група захворювань об’єднує будь-які порушення нормальної структури й функції нирок з подальшим виникненням ниркових і позаниркових розладів, що мають несприятливий вплив на більшість систем організму. Важливою проблемою в усьому світі на сьогодні є […]
